
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
| A、Na+、OH-、S2-、NO3- |
| B、AlO2-、K+、Fe3+、Na+ |
| C、Al3+、Cl-、HCO3-、Na+ |
| D、Fe2+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
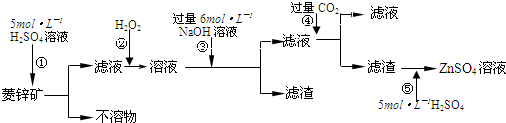
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、当光束通过鸡蛋清水溶液时,能观察到丁达尔效应 |
| C、水泥厂用高压电作用于气溶胶以除去烟尘,是根据胶体带电这个性质而设计的 |
| D、Li是最轻的金属,也是活动性强的金属,是制造电池的理想物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
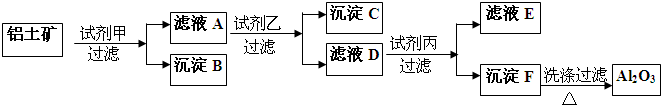
查看答案和解析>>
科目:高中化学 来源: 题型:
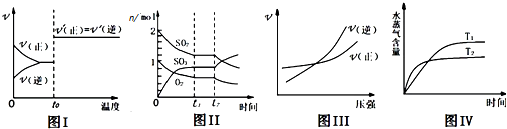
| A、图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
| B、图Ⅱ:反应2SO2+O2═2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
| C、图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
| D、图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
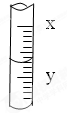
| A、4.30mL |
| B、4.6mL |
| C、4.3mL |
| D、4.60mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com