
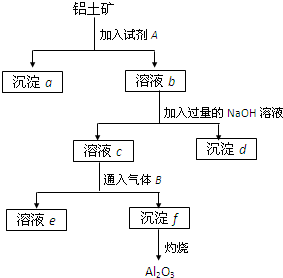
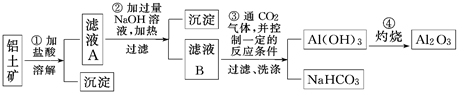
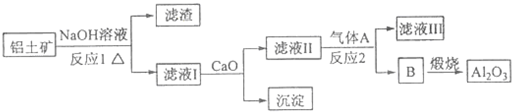
 铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
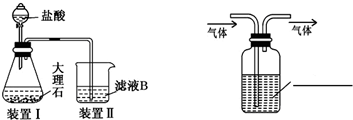
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、反应A+B
| ||||
| B、相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 | ||||
| C、相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀生锈 | ||||
| D、一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气、SO2都具有氧化性,故而可用于漂白纸浆等 |
| B、常温下浓硫酸能与铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| C、H2CO3是弱酸,所以NaHCO3是弱电解质 |
| D、较强的酸可以制取较弱的酸,次氯酸溶液无法制取盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
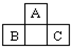 如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:
如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com