
����Ŀ������һ������ˮ��Һ��ֻ���ܺ������������е������֣�K+��NH4+��Cl����Mg2+��Ba2+��CO32����SO42������ȡ����100mL��Һ��������ʵ�飺
��1����һ�ݼ���AgNO3��Һ�г�������
��2���ڶ��ݼ�����NaOH��Һ���Ⱥ��ռ�������0.03mol����֪OH��+NH4+![]() NH3��+H2O��
NH3��+H2O��
��3�������ݼ�����BaCl2��Һ�ø������4.3g������������ϴ�ӡ������������Ϊ2.33g����������ʵ�飬�����Ʋⲻ��ȷ���ǣ�������
A.K+һ������B.100mL��Һ�к�0.01molCO32��
C.Cl�����ܴ���D.Ba2+��Cl��һ��������
���𰸡�D
��������
�������⣬��һ����Һ����AgNO3��Һ�г������������ܺ���Cl-��CO32-��SO42-�е�һ�ֻ���֣��ڶ�����Һ������NaOH��Һ���Ⱥ��ռ������壬˵��һ������NH4+����������Һ������BaCl2��Һ�ø������4.3g������������ϴ�ӡ������������Ϊ2.33g��˵��һ������CO32-��SO42-����һ��������Ba2+��Mg2+��������Һ���������ӵĵ���غ㣬�����ж�K+��Cl���Ƿ���ڡ�
A������������������Һ��һ������NH4+��CO32-��SO42-��һ��������Ba2+��Mg2+���ڶ��ݼ�����NaOH��Һ���Ⱥ��ռ�������0.03mol��˵������0.03mol NH4+�������ݼ�����BaCl2��Һ�ø������4.3g������������ϴ�ӡ������������Ϊ2.33g��BaSO4Ϊ2.33g���������������![]() =0.01mol��BaCO3Ϊ4.3g-2.33g�T1.97g������CO32-�����ʵ���Ϊ
=0.01mol��BaCO3Ϊ4.3g-2.33g�T1.97g������CO32-�����ʵ���Ϊ![]() =0.01mol�� CO32-��SO42-��������ɷֱ�Ϊ0.01mol��2��0.01mol��2����0.04mol��NH4+���������Ϊ0.03mol��������Һ�е���غ㣬��֪K+һ�����ڣ���A��ȷ��
=0.01mol�� CO32-��SO42-��������ɷֱ�Ϊ0.01mol��2��0.01mol��2����0.04mol��NH4+���������Ϊ0.03mol��������Һ�е���غ㣬��֪K+һ�����ڣ���A��ȷ��
B����A�ķ����ɵã�CO32-���ʵ���Ϊ0.01mol����B��ȷ��
C��CO32-��SO42-��NH4+���ʵ����ֱ�Ϊ0.01mol��0.01mol��0.03mol��CO32-��SO42-��������ɷֱ�Ϊ0.01mol��2��0.01mol��2����0.04mol��NH4+���������Ϊ0.03mol��������Һ�е���غ㣬��֪K+һ�����ڣ���K+���ʵ�����0.01mol����K+���ʵ�����0.01molʱ����Һ�л��������Cl-����C��ȷ��
D����Һ��һ������CO32-��SO42-��NH4+��һ��������Ba2+��Mg2+�����Dz����ж��������Ƿ���ڣ���D����
��ѡD��


 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ���о�̼�����仯��������ʾ�����Ҫ���塣
��1����ҵ����̿��ԭ��ͭ����Ҫ�ɷ���Cu2S��������ȡ����ͭ��
��֪��Ӧ���Ȼ�ѧ����ʽ���£�
C(s)+S2 (g) �TCS2 (g) ��H1=150 KJ/mol
Cu2S(s)+H2 (g) �T2Cu(s)+H2S (g) ��H2=59.5KJ/mol
2H2S (g) �T2H2 (g) +S2 (g) ��H3=170KJ/mol
ͨ�����㣬��֪��̿��ԭCu2S ��ȡ����ͭ��CS2��g�� ���Ȼ�ѧ����ʽΪ___________��
��2��Ϊ�о���Ӧ2H2S��g��![]() 2H2��g��+S2��g����������ҵ���̵�Ӱ�죬��ȤС���������̽����
2H2��g��+S2��g����������ҵ���̵�Ӱ�죬��ȤС���������̽����
�������������Ϊ1L�ĺ����ܱ������зֱ����1molH2S������H2S�ֽ�ʵ�顣��ͬ�¶��²��H2S ��ת������ʱ��Ĺ�ϵ��ͼ1��ʾ��

T1�¶��£�0��5min S2��g����ƽ����Ӧ����v��S2��=____________mol��L��1��min��1����Ӧƽ�ⳣ��K=_____molL��1���¶�T1��T2��T3 �ɸߵ��͵�˳����__________��
��T4�¶�ʱ����1L�ĺ����ܱ������м���1.8molH2��g����1.2molS2��g�����ﵽƽ�����S2��g����H2S��g����Ũ����ȣ���T4_____ T1 ��������������=��������������
��3��T��ʱ����ijŨ�ȵIJ�����Һ����μ���һ��Ũ�ȵ�NaOH ��Һ��������Һ��������H2C2O4��HC2O4����C2O42�� �����ʵ����������ģ� ��pH�Ĺ�ϵ��ͼ2��ʾ��
�ٲ���ĵ��볣���ֱ�ΪK1��K2����![]() =_____��
=_____��
�ڰ�Ͷ�ϱ�n��Na2C2O4����n��NaHC2O4��=2��1�����Һ�������йظ���Һ��������ȷ����_____������ţ���
A������Һ��pHΪ4.2
B.3c��Na+��+c��H+��=c��OH����+c��HC2O4����+2c��C2O42����
C.3c��Na+��=5[c��HC2O4����+c��C2O42����+c��H2C2O4��]
D.3c��OH����+c��C2O42����=3c��H+��+2c��HC2O4����+5c��H2C2O4��
��4����̼�ļ״���CH3OH���ķ�ˮ�����ŷŻ����ˮ��Ⱦ������ClO2��������ΪCO2��Ȼ���ټӼ��кͼ��ɡ�
��д�������״����Է�ˮ�����У�ClO2��״���Ӧ�����ӷ���ʽ��___________________��
�ڳ����£���100 mL0.1mol/L��NaOH��Һ��ͨ��һ������CO2��Ϊ̽����Ӧ������Һ�ijɷ֣���������μ���0.1 mol/L��HCl��Һ����Һ��������ǰ������V( HCl)=V1����Һ�պò��ٲ�������ʱ������V( HCl) =V2����V1 <V2 <2Vlʱ�������Һ�����ʵijɷ�Ϊ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A. ����FeCl3��Һʱ������Һ�м�����������
B. ʵ�������ű���ʳ��ˮ�ķ����ռ�����
C. ��������Һ�м������������CH3COO-������
D. H2��I2��HIƽ��ʱ�Ļ�������ѹ����ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ��͵İ뵼����ϣ��ڹ������µ����Կ���߽�ǧ������ͼ�Ǵ�ij�������������뵼�����(��Ag2Se��Cu����)����ȡ�������Ĺ�������ͼ��

�ش��������⣺
��1��Ϊ��߷�Ӧ�ٵĽ������ʣ��ɲ��õĴ�ʩΪ____���������)��
��2����֪��Ӧ������һ�ֿɲ������ѭ�������嵥�ʣ�д���÷�Ӧ�����ӷ���ʽ____��
��3����Ӧ��ΪAg2SO4(s)+2Cl-(aq)=2AgCl(s)+SO42-(aq)�������µ�Ag2SO4��AgCl�ı�����Һ�������Ӻ�������Ũ�ȹ�ϵ��ͼ��ʾ����Ag2SO4(s)+2Cl-(aq)=2AgCl(s)+SO42-(aq)�Ļ�ѧƽ�ⳣ����������Ϊ____��

��4��д����Ӧ�ܵĻ�ѧ����ʽ____��
��5�������£�H2SeO3ˮ��Һ��H2SeO3��HSeO3-��SeO32-��Ħ��������pH�ı仯��ͼ��ʾ����������H2SeO3��Ka2=___��
��6����ҵ�ϴ�����⾫��ʱ�����Һ��pHΪ1.5~2������ǿ��Ϊ5~10A�������ҺpH̫С����⾫�����������������������ӷŵ磬���ᷢ��____(д�缫��Ӧʽ)������10A�ĵ������60min�õ�32.4gAg����õ��صĵ��Ч��Ϊ____%��(����С�����һλ��ͨ��һ������ʱ������ʵ�ʳ����Ľ���������ͨ����ͬ����ʱ������Ӧ�����Ľ�������֮�Ƚе��Ч�ʡ������ڳ���Ϊ96500C��mol-1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������F��һ��ҩ��ϳɵ��м��壬F��һ�ֺϳ�·�����£�

��֪��

�ش��������⣺
��1��![]() ������Ϊ____��
������Ϊ____��
��2��D�к��������ŵ�����Ϊ____��
��3��B��C�ķ�Ӧ����ʽΪ____��
��4��D��E�ķ�Ӧ����Ϊ____��
��5��C��ͬ���칹���ж��֣����б�����������ONa��2����CH3��ͬ���칹�廹��____�֣�д���˴Ź�������Ϊ3��壬�����֮��Ϊ6:2:1��ͬ���칹��Ľṹ��ʽ____��
��6�����������ƣ� ����һ�ָ�Ч����ҩ��ο����Ϻϳ�·���е������Ϣ�������
����һ�ָ�Ч����ҩ��ο����Ϻϳ�·���е������Ϣ�������![]() Ϊԭ�ϣ�����ԭ����ѡ���ϳ����������Ƶĺϳ�·�ߡ�________________
Ϊԭ�ϣ�����ԭ����ѡ���ϳ����������Ƶĺϳ�·�ߡ�________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£������������ǿ��淴ӦA(g)��3B(g) ![]() 2C(g)�ﵽƽ��״̬��־��������λʱ��������a mol A��ͬʱ����3a mol B����C���ɵ�������C�ֽ��������ȣ� ��A��B��C��Ũ�Ȳ��ٱ仯����A��B��C��ѹǿ���ٱ仯��������������ѹǿ���ٱ仯����A��B��C�ķ�����֮��Ϊ1��3��2����λʱ��������a mol A��ͬʱ����3a mol B���������������ʵ������ٱ仯��
2C(g)�ﵽƽ��״̬��־��������λʱ��������a mol A��ͬʱ����3a mol B����C���ɵ�������C�ֽ��������ȣ� ��A��B��C��Ũ�Ȳ��ٱ仯����A��B��C��ѹǿ���ٱ仯��������������ѹǿ���ٱ仯����A��B��C�ķ�����֮��Ϊ1��3��2����λʱ��������a mol A��ͬʱ����3a mol B���������������ʵ������ٱ仯��
A. �ڢ� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڷ�����ᴿ���ʵķ�����:�ٹ��� ������ �ۼ��� �ܷ�Һ(�����пհ�����д�����ᴿ�ĺ�����������ż�װ���º�����ѡ��)��

��1����ȥʯ��ˮ��������CaCO3����:________��
��2���ᴿ�Ȼ�����Һ�е��Ȼ���:___��
��3���������ͺ�ú�͵Ļ����:______��
��4������ˮ�ͱ��Ļ����:___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��Ԫ�ض�ֲ�����������彡������ʮ����Ҫ�����ã���Ļ����ﱻ�㷺Ӧ�����²����Ʊ��������������������
��1��������ԭ�ӵ����Ų�ͼ��ʾ��״̬�У�������ͺ���ߵķֱ�Ϊ________��________�����ţ�
A��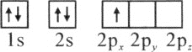
B��
C��
D��
��2�������������Է����ֳ�����ʮ����Ķ��������Σ��������ʳ�Ϊ�����________��
��3����Ԫ�صļ��⻯��BH3����������ڣ����������γɽ��ȶ���B2H6�����������ӽ�ϡ�
��B2H6���ӽṹ��ͼ����Bԭ�ӵ��ӻ���ʽΪ________��

�ڰ����飨NH3BH3������Ϊ�����DZ�������ʹ������֮һ�������д�����λ�����ṩ�µ��ӶԵijɼ�ԭ����________��д��һ���백���黥Ϊ�ȵ�����ķ���________���ѧʽ����
��4�������ᣨH3BO3��Ϊԭ�Ͽ��Ƶ����⻯�ƣ�NaBH4���������л��ϳ��е���Ҫ��ԭ����
��H3BO3�����е�Ԫ�ṹ��ͼ����ʾ������Ԫ�е���ԭ��ͨ��________������á�A��B��C����ʾ��A��B��C��ʾԭ�ӣ�����ɲ�״�ṹ����Ƭ��ṹ��ͼ����ʾ�������֮����________�������������ƣ����Ϲ����������ᾧ�塣

�����⻯����![]() �ļ��Ǵ�С��________�����幹��Ϊ________��
�ļ��Ǵ�С��________�����幹��Ϊ________��
�۸��������ṹ�ж�����˵����ȷ����________
a��H3BO3���ӵ��ȶ���������й�
b�����ᾧ���л���У�������
c��H3BO3��������ԭ�������Ϊ8e���ȶ��ṹ
d����1mol H3BO3�ľ�������3 mol���
��5������BP�����ܸ߶ȹ�ע����ĥ���ϣ�����Ϊ��������ı����㣬��ṹ����ʯ���ƣ������ṹ��ͼ��ʾ��������z����ƽ���ͶӰͼ�У�Bԭ�ӹ��ɵļ�����״��________����֪�����߳�Ϊa pm������������ܶ���________g��cm��3���г���a��NA�ļ���ʽ���ɣ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������³���� (  ) ��һ�����õľֲ�����ҩ�� ���ж���С�� ����Ե��ص㡣��ϳ�·������ͼ��ʾ��
) ��һ�����õľֲ�����ҩ�� ���ж���С�� ����Ե��ص㡣��ϳ�·������ͼ��ʾ��

�ش��������⣺
(1) 3molA���Ժϳ�1molB�� ��B��ƽ���������νṹ�� ��B�Ľṹ��ʽΪ_________��
(2) �л���C������Ϊ____________�� B��C�ķ�Ӧ����Ϊ_____________��
(3) ��ӦC��D�Ļ�ѧ����ʽΪ________________________________________��
(4) F��E����������Ӧ����G�� ��F�Ľṹ��ʽΪ___________________��
(5) H�ķ���ʽΪ____��
(6) ����ʽΪC9H12����C��ͬϵ���ͬ���칹�干��__________�֡�
(7) ��������������Ϣ�� ����ɱ��� ��ȲΪԭ�Ϻϳ� ��·��_______________ ��(�������Լ���ѡ)
��·��_______________ ��(�������Լ���ѡ)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com