
下列装置进行相应的实验,能达到实验目的的是
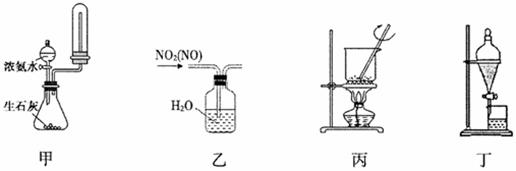
A.用装置甲制取并收集干燥纯净的NH3 B.用装置乙除去NO2中的少量NO
C.用装置丙将海带灼烧成灰 D.用装置丁分离乙酸乙酯和饱和碳酸钠溶液
科目:高中化学 来源: 题型:
含有下列各组离子的溶液中通入(或加入)过量的某种物质后仍能大量共存的是
A.H+、Ba2+、Fe3+、NO3-,通入SO2气体
B.Ca2+、Cl-、K+、H+,通入CO2气体
C.AlO2-、Na+、Br-、SO42-,通入CO2气体
D.HCO3-、Na+、I-、HS-,加入AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现为了测定某黄铜矿的纯度,某同学设计了如下实验,已知d中试剂能将所吸收的气体充分吸收:
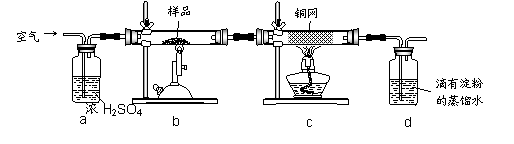 |
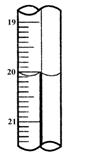
现称取研细的黄铜矿样品2.0g,在空气中煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的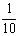 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,末读数如右图所示。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,末读数如右图所示。请回答下列问题:
(1)称量样品所用的仪器为 ,将样品研细后再反应,其目的是 。
(2)装置a的作用是 。
A、有利于空气中氧气充分反应 b、除去空气中的水蒸气
C、有利于气体混合 d、有利于观察空气流速
(3)b中发生的反应方程式为 。
 (4)滴定时,标准碘溶液所耗体积为 mL。
(4)滴定时,标准碘溶液所耗体积为 mL。
判断滴定已达终点的现象是______
。
(5)通过计算可知,该黄铜矿的纯度为 。
(6)若用右图装置替代上述实验装置d,同样
可以达到实验目的的是 。(填编号)
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温、恒压下,a mol A和b molB在一个容积可变的容器中发生反应:A(g)+2B(g)⇌2C(g),一段时间后达到平衡,生成n mol C.下列说法正确的( )
|
| A. | 物质A、B的转化率之比为l:2 |
|
| B. | 起始时刻和达到平衡后容器中的压强之比为(a+b):(a+b﹣) |
|
| C. | 当2v正(A)=v逆(B)时,反应一定达到平衡状态 |
|
| D. | 充入惰性气体,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
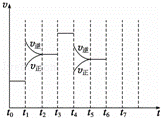
在一密闭容器中发生反应N2+3H2⇌2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
回答下列问题:
(1)处于平衡状态的时间段是 ACDF (填选项).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 A (填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线.
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 5:6 .
查看答案和解析>>
科目:高中化学 来源: 题型:
单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法正确的是 ( )
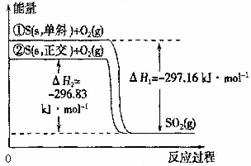
A.S(s,单斜) = S(s,正交) △H = + 0.33 kJ·mol-1
B.相同物质的量的正交硫比单斜硫所含有的能量高
C.正交硫比单斜硫稳定
D.①表示断裂1mol O2中的共价键所吸收的能量比形成l mol SO2中的共价键所放出的能量少297.16 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
某科研小组设计出利用工业废酸(稀H2SO4)浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
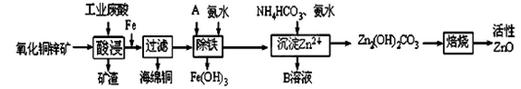
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是 。
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(3)物质A最好使用下列物质中的 。
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(5)物质B可直接用作氮肥,则B的化学式是 。
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
无色溶液可能由K2CO3、MgCl2、NaHCO3、BaCl2溶液中的一种或几种组成。向溶液中加入烧碱溶液出现白色沉淀,加入稀硫酸也出现白色沉淀并放出气体。据此分析,下列判断中正确的是( )
①肯定有BaCl2 ②肯定有MgCl2 ③肯定有NaHCO3
④肯定有Na2CO3或NaHCO3 ⑤肯定没有MgCl2
A.①②③ B.②④ C.①③ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
关于钠的叙述中,正确的是 ( )
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上用酒精灯加热,熔化后剧烈燃烧,产生黄色火焰,生成淡黄色固体
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com