
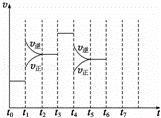
在一密闭容器中发生反应N2+3H2⇌2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
回答下列问题:
(1)处于平衡状态的时间段是 ACDF (填选项).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 A (填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线.
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 5:6 .
| 化学平衡状态的判断;化学平衡的影响因素;化学反应速率变化曲线及其应用.. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)根据图示结合v正=v逆,判断是否处于平衡状态; (2)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,根据移动结果分析; (3)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线; (4)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,根据三段式和氨气的体积分数计算. |
| 解答: | 解:(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态,故答案为:ACDF; (2)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大, 故答案为:A; (3)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线为:
(4)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3, N2(g)+3H2(g)⇌2NH3(g) 起始 a b 0 转化 x 3x 2x 平衡 a﹣x b﹣3x 2x 则反应后气体总的物质的量=(a+b﹣2x)mol, 故答案为:5:6. |
| 点评: | 本题考查影响化学反应速率的因素,注意把握反应的特点及图象分析是解答的关键,明确温度、压强、催化剂对反应速率的影响即可解答,题目难度不大. |


科目:高中化学 来源: 题型:
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中,属干这种情况的是
①过量锌与18 mol/L的硫酸反应;
②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与大块状石灰石反应。
A.②③④⑥ B.②③⑤ C.①④⑤ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.某酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a≤b-1
B.在滴酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的c (NH4+) = c(Cl-)
C.常温下,某硫酸溶液的pH=3,升高其温度,溶液pH增大
D.相同温度、相同体积、相同物质的量浓度的KI和KF溶液中,离子总数前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=﹣905.9kJ•mol﹣1,下列叙述正确的是( )
|
| A. | 4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ |
|
| B. | 平衡时v正(O2)=v逆(NO) |
|
| C. | 平衡后减小压强,混合气体平均摩尔质量增大 |
|
| D. | 平衡后升高温度,混合气体中NO含量降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
研究NO2、SO2、等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为 3NO2+H2O=NO+2HNO3 .利用反应6NO2+8NH3 7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 6.72 L.
7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 6.72 L.
(2)已知:2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣1
2NO(g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ•mol﹣1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的△H= ﹣41.8 kJ•mol﹣1.
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 b .
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列装置进行相应的实验,能达到实验目的的是
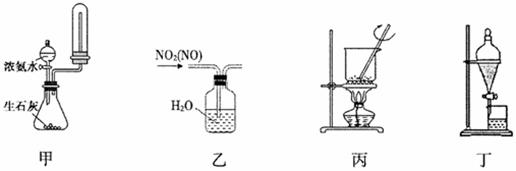
A.用装置甲制取并收集干燥纯净的NH3 B.用装置乙除去NO2中的少量NO
C.用装置丙将海带灼烧成灰 D.用装置丁分离乙酸乙酯和饱和碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
普罗加比对癫痫、痉挛和运动失调均有良好的治疗效果,其结构如图所示,有关普罗加比的说法正确的是( )
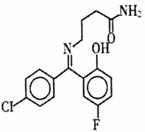
A.该分子在1H核磁共振谱中有12个峰
B.一定条件下,1 mol普罗加比最多能与2 mol H2发生加成反应
C.久置在空气中的普罗加比会因氧化而变质
D.普罗加比可以和NaOH溶液、Na2CO3溶液反应,也可以和盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| ① | 过量的 | 溶液呈红色 | 稀 |
| ② | AgI沉淀中滴入稀 | 有白色沉淀出现 |
|
| ③ | Al箔插入稀 | 无现象 |
|
| ④ | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| ⑤ | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| ⑥ | 将足量的 |
| 2MnO4-+7H2O2+6H+=2Mn2++6O2↑+10H2O |
| ⑦ | 将一小块 | 产生气泡 |
|
| ⑧ | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下反应 |
A.①④⑤⑥⑦ B.④⑤ C.④⑤⑦ D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
2阅读下列A、B、C、D、E、F六种短周期元素的相关信息。
①含A的物质焰色反应为黄色。 ②B的原子最外层电子数是其内层电子数的3倍。③C的最简单离子与Ne原子的电子数相同,且在具有相同电子数的简单离子中离子半径最小。④D与B处于同主族。 ⑤目前人类已知的物质(包括人工制造的物质)中,大多数都含有E元素。 ⑥F元素的某种原子中只有质子,没有中子。请根据上述信息回答问题:
(1)由已知六种元素中的三种组成的易溶于水的物质中,能促进水电离的物质是________(写出一种物质的化学式,下同),能抑制水电离的物质是________。
(2)海水电源主要用于海上航标灯及相类似的海上用电设施,电源利用海水做电解液,空气中的氧做阴极活性物,C的单质作为阳极。写出这种海水电源的正极反应式:
(3)常温下,向体积为1.5 L、浓度为0.1 mol·L-1的A的最高价氧化物对应水化物的水溶液中通入2.24 L(标准状况)EB2气体,待反应充分后,溶液中各离子浓度由大到小的顺序是_______
(4)常温下,向c(H+)=1 mol/L,c(Al3+)=c(Fe3+)=0.04 mol·L-1的溶液中加入A的最高氧化物对应水化物的溶液,以调节溶液的pH(假设溶液体积不变)。那么最先析出的沉淀是____ __(写化学式),刚刚析出沉淀时溶液的pH=______。(已知Ksp[Al(OH)3]=1.3×10-33 mol4·L-4,Ksp[Fe(OH)3]=2.6×10-39 mol4·L-4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com