
研究NO2、SO2、等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为 3NO2+H2O=NO+2HNO3 .利用反应6NO2+8NH3 7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 6.72 L.
7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 6.72 L.
(2)已知:2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣1
2NO(g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ•mol﹣1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的△H= ﹣41.8 kJ•mol﹣1.
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 b .
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= .
| 用盖斯定律进行有关反应热的计算;化学平衡状态的判断.. | |
| 专题: | 化学反应中的能量变化;化学平衡专题. |
| 分析: | (1)二氧化氮可以和水反应生成硝酸和一氧化氮,根据化学方程式以及电子转移知识来回答; (2)根据盖斯定律来计算化学反应的焓变,根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;根据三行式以及化学平衡常数表达式计算化学平衡常数. |
| 解答: | 解:(1)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO;6NO2+8NH3═7N2+12H2O,当反应中有1 mol NO2参加反应时,共转移了4 mol电子,故转移1.2mol电子时,消耗的NO2为1.2××22.4L=6.72L,故答案为:3NO2+H2O=NO+2HNO3;6.72; (2)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=﹣83.6 kJ•mol﹣1,则NO2+SO2⇌SO3+NO,△H=﹣41.8 kJ•mol﹣1; 本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据,故选b; NO2(g)+SO2(g) 起始物质的体积 1a 2a 0 0 转化物质的体积 x x x x 平衡物质的体积 1a﹣x 2a﹣x x x 则(1a﹣x):(2a﹣x)=1:6,故x=a,故平衡常数为=x2/(1a﹣x)(2a﹣x)=. 故答案为:﹣41.8;b;. |
| 点评: | 本题将元素化合物与能量变化、化学平衡等知识柔和在一起进行考察,充分体现了高考的综合性,看似综合性较强的问题,只要细细分析,还是能各个突破的. |


科目:高中化学 来源: 题型:
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑2NO2 N2O4)。
N2O4)。
(1)硝酸在该反应中的作用是__________________。(1分)
(2)0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为____________;所得溶液(假设溶质不扩散)的物质的量浓度是___________ 。
(3)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式_________________________________________________________。
(4)如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组,其原因是_ ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯亚甲基苯乙酮俗称查尔酮,淡黄色梭状晶体,熔点58℃,沸点208℃(3.3kp),易溶于醚、氯仿和苯,微溶于醇。制备原理如下:


(1)制备过程中。需在搅拌下滴加苯甲酸,并控制滴加速度使反应温度维持在25~30℃,说明该反应是 (填“放热”或“吸热”)反应。如温度过高时,则可采用 措施。
(2)产品结晶前,可以加入几粒成品的查尔酮,其作用是 。
(3)结晶完全后,需抽滤收集产物。’抽滤装置所包含的仪器除减压系统外还有 、 (填仪器名称)。
(4)获得的深色粗产品加入活性炭,用95%乙醇重结晶即得查尔酮晶体,可通过 法判断原料是否反应完全以及反应的转化率和选择性。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2═2N0,经测定前3s用N2表示的反应速率为0.1mol/(L•s),则6S末N0的浓度为( )
|
| A. | 1.2 mol•L﹣1 | B. | 大于1.2 mol•L﹣1 | C. | 小于1.2 mol•L﹣1 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一个2L的密闭容器中加入4mol A和2mol B进行如下反应:3A(g)+2B(g)⇌4C(s)+D(g),反应2min后达到平衡,测得生成1.6mol C,下列说法正确的是( )
|
| A. | 前2 min D的平均反应速率为0.2 mol•L﹣1•min﹣1 |
|
| B. | 此时,B的平衡转化率是40% |
|
| C. | 增大该体系的压强,平衡不移动 |
|
| D. | 增加B,平衡向右移动,B的平衡转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
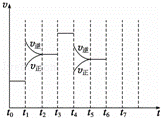
在一密闭容器中发生反应N2+3H2⇌2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
回答下列问题:
(1)处于平衡状态的时间段是 ACDF (填选项).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 A (填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线.
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 5:6 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是
A.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O → C6H5OH+HCO3-
B.AlCl3溶液中加入少量氨水:Al3++3OH- = Al(OH)3↓
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH- = Fe(OH)2↓
D.用惰性电极电解氯化钠溶液:2Cl-+2H+ 通电 H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
纯碱和小苏打是厨房中两种常见用品,下列区分它们的做法正确的是 ( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用洁净铁丝蘸取两种样品在煤气灯火焰上灼烧,火焰颜色发生明显变化的是小苏打
C.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打
D.用两只玻璃杯分别加入少量的两种样品,再加入等量的食醋,产生气泡速度快的是小苏打
查看答案和解析>>
科目:高中化学 来源: 题型:
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol/L的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是
 A.Cu与Cu2O的物质的量之比为2∶1
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2.6 mol/L
C.产生的NO在标准状况下的体积为4.48 L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com