
【题目】下列实验事实不能作为所得结论合理证据的是
选项 | A | B | C | D |
实验 |
|
|
|
|
现象 | NaBr溶液变为橙色,NaI溶液变为棕黄色 | Mg条表面有气泡产生 | Na2SiO3溶液中出现白色沉淀 | 钾与水反应比钠与水反应更剧烈 |
结论 | 氧化性: Cl2>Br2>I2 | 还原性: Mg>Al | 非金属性: C>Si | 金属性: K>Na |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称,下列有关![]() 和
和![]() 的说法正确的是( )
的说法正确的是( )
A.![]() 和
和![]() 原子中均含有22个质子B.
原子中均含有22个质子B.![]() 和
和![]() 的中子数相同
的中子数相同
C.Ti元素的相对原子质量为49D.![]() 和
和![]() 为同一核素
为同一核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,实验室拟用下图所示装置制备干燥纯净的氯气,请回答下列问题。
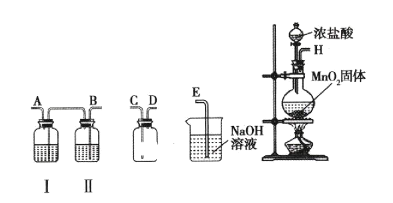
(1)I中所盛试剂为________(填序号,下同),II中所盛试剂为________。
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按正确的顺序连接装置:H→____、____、→____、____→____;选择最后一个装置的目的是___________________。
(3)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:____。
(4)实验室有一瓶密封不严的漂白粉样品,其中肯定含有![]() ,请设计实验探究该样品中可能存在的其他物质。
,请设计实验探究该样品中可能存在的其他物质。
I.提出合理假设。
假设1:该漂白粉未变质,含有_______________________;
假设2:该漂白粉全部变质,含有_________________________;
假设3:该漂白粉部分变质,既含有![]() ,又含有
,又含有![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种芳香族化合物都是某些植物挥发油中主要成分,有的是药物,有的是香料。它们的结构简式如下所示:

(1)写出上述有机物A中官能团的名称___________。
(2)能与新制Cu(OH)2反应的有________(用A、B、C、D填写)。写出含氧原子数较少的物质与新制Cu(OH)2反应生成砖红色沉淀的化学反应方程式:___。
(3)①D一种同分异构体G的结构简式为![]() ,写出G与足量NaOH溶液共热反应的化学方程式:___________。
,写出G与足量NaOH溶液共热反应的化学方程式:___________。
②D的另一种同分异构体H,其苯环上有两个相邻的取代基,它既能使FeCl3溶液变紫色,又能与NaHCO3溶液反应放出CO2气体,H的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是__________。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显____性,用化学平衡原理解释:_____。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):___。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)能证明Na2SO3溶液中存在SO32-+H2O![]() HSO3-+OH-水解平衡的事实是____(填序号)。
HSO3-+OH-水解平衡的事实是____(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学方程式书写正确的是
A. 乙烯与溴的加成反应: H2C===CH2+Br2 → CH3CHBr2
B. 苯与硝酸的取代反应:![]() +HNO3
+HNO3 ![]() +H2O
+H2O
C. 乙醇与氧气的催化氧化:2CH3CH2OH+O2 ![]() 2CO2+3H2O
2CO2+3H2O
D. 乙醇与乙酸的酯化反应:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
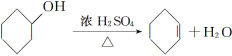
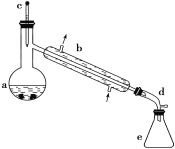
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__________。
(2)本实验中最容易产生的副产物的结构简式为_______。
(3)在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是______。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有____(填正确答案标号)。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(6)以下区分环己烯精品和粗品的方法,合理的是______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
 +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为:0.2mol/L、0.1mol/L和0.2mol/L。当反应达到平衡时可能存在的数据正确的是
2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为:0.2mol/L、0.1mol/L和0.2mol/L。当反应达到平衡时可能存在的数据正确的是
A.c(O2)=0.2mol/LB.c(SO2)=0.25mol/L
C.c(SO3)=0.4mol/LD.c(SO2)=c(SO3)=0.15mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com