
| A. | 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ | |
| D. | 由Al、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
分析 A.该原电池中,Al易失电子作负极,负极上发生氧化反应;
B.该原电池中,Al易失电子作负极,负极上Al失电子和氢氧根离子反应生成偏铝酸根离子和水;
C.该原电池中,Al发生钝化现象,所以Cu易失电子作负极;
D.该原电池中,Al易失电子作负极.
解答 解:A.该原电池中,Al易失电子作负极,负极上发生氧化反应,电极反应式为Al-3e-=Al3+,故A正确;
B.该原电池中,Al易失电子作负极,负极上Al失电子和氢氧根离子反应生成偏铝酸根离子和水,电极反应式为Al-3e-+4OH-=AlO2-+2H2O,故B正确;
C.该原电池中,Al发生钝化现象,所以Cu易失电子作负极,电极反应式为Cu-2e-=Cu2+,故C正确;
D.该原电池中,Al易失电子作负极,电极反应式为Al-3e-=Al3+,故D错误;
故选D.
点评 本题考查电极反应式的书写,明确原电池原理及正负极的判断方法是解本题关键,注意BC中正负极的判断,B中Mg不反应、C中Al不反应,注意:不能比较金属的活泼性强弱判断正负极,为易错点.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和乙胺反应属于加成反应 | |
| B. | 室溫离子可以使熔盐燃料电池在常溫下工作 | |
| C. | CH3CH2NO3中,只有σ键没有π键 | |
| D. | 融化CH3CH2•NO3晶体需要破坏分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ca2+、HSO3-、Cl- (氨气) | B. | Ba2+、NO3-、Na+、Cl- (二氧化硫) | ||
| C. | Na+、K+、HCO3-、Cl- (二氧化碳) | D. | Al3+、SO42-、HCO3-、NO3- (氯化氢) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝需经过特别处理才具有抗腐蚀能力 | |
| B. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| C. | Li是最轻的金属也是活动性很强的金属,是制造电池的理想物质 | |
| D. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
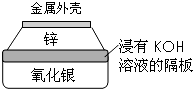 金属作为一种能源受到越来越多的关注.
金属作为一种能源受到越来越多的关注.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
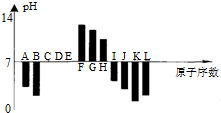
| A. | 元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大. | |
| B. | 根据图形分析可知,K,L两种元素最高价氧化物对应的水化物的酸性,前者较强. | |
| C. | 晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同. | |
| D. | 元素K、H、G分别形成的简单离子的半径逐渐减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混盐水溶液呈碱性 | |
| B. | 该混盐与H2SO4反应有气体生成 | |
| C. | 该混盐溶液加入BaCl2可以生成白色沉淀 | |
| D. | 该混盐在酸性条件下可生成S,每产生32g S转移2NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com