
【题目】若m g Al在足量氯气中燃烧,生成固体的质量为(m+21.3)g,将m g Al投入总质量为95.2gNaOH水溶液中恰好完全反应。下列判断正确的是( )
A.m=2.7
B.Al与Cl2反应的产物溶于水,所得溶液中加入足量氨水,先出现沉淀,后又溶解
C.若在原NaOH溶液中通入足量Cl2,理论上可生成0.2molNaClO
D.Al与NaOH溶液反应后所得溶液中溶质的质量分数为16.4%
【答案】D
【解析】
Al与氯气反应生成氯化铝,根据固体增重,可知增重为氯元素的质量,根据![]() ,计算氯原子的物质的量,根据化学式可得
,计算氯原子的物质的量,根据化学式可得![]() ,铝与氢氧化钠反应,生成偏铝酸钠和氢气,依据铝的物质的量计算氢气的物质的量与偏铝酸钠的物质的量,然后计算质量分数即可。
,铝与氢氧化钠反应,生成偏铝酸钠和氢气,依据铝的物质的量计算氢气的物质的量与偏铝酸钠的物质的量,然后计算质量分数即可。
A.mgAl在足量氯气中燃烧,生成AlCl3的质量为(m+21.3)g,则m(Cl)=21.3g,故![]() ,据AlCl3化学式可得
,据AlCl3化学式可得![]() ,故
,故![]() ,
,![]() ,故A错误;
,故A错误;
B.Al与Cl2反应生成AlCl3,向AlCl3溶液中加入足量氨水,生成Al(OH)3沉淀,Al(OH)3沉淀不溶于过量氨水,故B错误;
C.Al和NaOH溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(NaOH)= ![]() ,所以若在原NaOH溶液中通入足量Cl2,发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,可生成0.1molNaClO,故C错误;
,所以若在原NaOH溶液中通入足量Cl2,发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,可生成0.1molNaClO,故C错误;
D.依据铝元素守恒,生成偏铝酸钠物质的量为0.2mol,故质量为:![]() ,故失去电子数为
,故失去电子数为![]() ,即生成氢气为:0.3mol,质量为0.6g,故溶质的质量分数为:
,即生成氢气为:0.3mol,质量为0.6g,故溶质的质量分数为:![]() ,故选D。
,故选D。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列判断正确的是( )
A.NA个O2和28g N2所占的体积都约为22.4 L
B.标准状况下,22.4 L H2O含有NA个水分子
C.71g Cl2与足量NaOH溶液反应,转移的电子数为2NA
D.1.8g的NH4+ 离子中含有的电子数NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )

A.OA段所发生反应的离子方程式:H++OH﹣=H2O;CO32﹣+H+=HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经多年勘测,2018年11月23日省自然资源厅发布消息称在皖江地区发现特大铜矿床,具有重大实际意义。以黄铜矿(主要成分为CuFeS2,含有少量PbS、Al2O3、SiO2)为原料制取胆矾的流程如下图:

已知:常温下Ksp[Fe(OH)3]=8.0×10-38, Ksp[Al(OH)3]=3.0×10-33,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______,硫元素在周期表中的位置是______________。写出上述流程中生成亚硫酸铵的离子方程式:_______________________________。
(2)最适合的试剂A是________(写化学式)溶液,固体2的成份为PbSO4和_______。当试剂A的浓度为6mol·L-1时 ,“浸出”实验中,铜的浸出率结果如图所示。所采用的最佳实验条件(温度、时间)为_______________。

(3)最适合的试剂B是_______(填序号),最适合的试剂C是______(填序号),固体3的成份为_________________________。
a.Cl2 b.CuO c.酸性高锰酸钾溶液 d.NaOH e.H2O2 溶液 f.K2CO3
(4)操作1如在实验室中进行,用到的玻璃仪器有烧杯、玻璃棒和_______,操作2的步骤为________________过滤、洗涤。
(5)根据已知信息,请计算:当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为______。(提示:当离子浓度≤1×10-5mol·L时,认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属在人类社会发展进程中发挥了重要作用,钠、镁、铝、铁、铜是最重要的几种金属。
(1)上述五种金属中人们发现并最早制得其单质的是_____________。
(2)这五种金属单质都具有的性质是_________________(填下列选项的序号)。
a.导电性 b.延展性 c.银白色 d.熔点高 e.硬度大
(3)钠、镁、铝、铁四种金属中,不能用于从氯化铜溶液中置换出铜的金属是_________,原因是 _________(用必要的化学方程式表示)。
(4)上述金属中,有一种金属的氧化物能在另一种金属的氢氧化物的水溶液中溶解,写出反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L CH3COONa溶液pH=9,则下列说法正确的是
A. 加入少量NaOH固体后溶液pH小于9
B. 加水稀释,CH3COONa水解程度增大,c(OH-)增大
C. 该溶液水电离出的c(OH-)=10-9
D. CH3COOH在常温下Ka数值约为1×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应式为3Zn-6e-+6OH-=3Zn(OH)2
B. 充电时阳极反应式为2Fe(OH)3+10OH--6e-=2FeO42-+8H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D. 放电时正极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
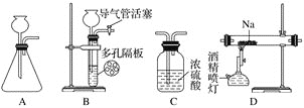
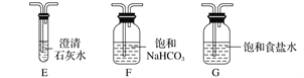
请回答下列问题:
(1)选择必要的仪器,按________顺序连接好装置(填装置序号)。
(2)检验装置B气密性的方法:_____________。
(3)实验时,在点燃酒精喷灯前必须进行的操作是________,待装置E中出现____现象时,再点燃酒精喷灯,以上操作的目的是____________。
(4)加热一段时间后观察到钠块表面变黑,继续加热后,钠燃烧,有白烟生成。两种产物中有一种是重要的化工原料,在玻璃工业中用量很大。则钠与二氧化碳反应的化学方程式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com