
【题目】NA表示阿伏伽德罗常数,下列判断正确的是( )
A.NA个O2和28g N2所占的体积都约为22.4 L
B.标准状况下,22.4 L H2O含有NA个水分子
C.71g Cl2与足量NaOH溶液反应,转移的电子数为2NA
D.1.8g的NH4+ 离子中含有的电子数NA
【答案】D
【解析】
A. NA个O2和28g N2的物质的量都是1mol,若氧气和氮气所处的状态是标准状况,则1molO2和1molN2所占有的体积都约是22.4L,选项没有说明是在标况下,所以1molO2和1molN2所占有的体积可能为22.4L,可能不是,故A错误;
B. 标准状况下水是液体,不能使用气体摩尔体积22.4L/mol计算,故B错误;
C. 依据n=![]() 计算物质的量=
计算物质的量=![]() =1mol,结合氯气既是氧化剂又是还原剂,元素化合价0价变化为-1价和+1价,转移的电子数为1NA,故C错误;
=1mol,结合氯气既是氧化剂又是还原剂,元素化合价0价变化为-1价和+1价,转移的电子数为1NA,故C错误;
D. 1.8g NH4+的物质的量为![]() =0.1mol,1个NH4+有10个电子,0.1mol NH4+离子中含有的电子数NA,故D正确;
=0.1mol,1个NH4+有10个电子,0.1mol NH4+离子中含有的电子数NA,故D正确;
正确答案是D。


科目:高中化学 来源: 题型:
【题目】1,3—二异丙烯基苯![]() 是重要的化工原料。下列有关1,3一二异丙烯基苯的说法正确的是
是重要的化工原料。下列有关1,3一二异丙烯基苯的说法正确的是
A.可以发生加成聚合反应B.不能使稀高锰酸钾溶液褪色
C.分子中所有原子共平面D.其苯环上的二氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是( )
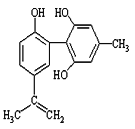
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子可能共平面
D.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为1mol和7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素是重要的金属元素,铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素具有氧化性也有还原性的物质是_________。
a.铁单质 b.氯化亚铁 c.铁红 d.Fe3O4
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:____ Fe(OH)3+___ ClO-+_______=____FeO42-+____Cl-+______
(3)电子工业上用氯化铁腐蚀铜箔,制造印刷电路板,并从使用过的腐蚀废液(含有FeCl2、CuCl2、FeCl3)中回收铜,并获得氯化铁晶体,其工艺流程如下:回答下列问题:
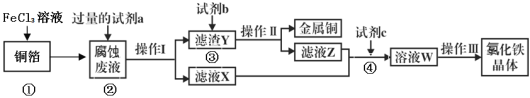
①反应①的化学方程式:_______________;
②从反应①和②可以判断出Fe2+、Cu2+、Fe3+的氧化性从强到弱顺序为:____________;
③操作I用到的玻璃仪器有烧杯、玻璃棒和___________;
④滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是( )
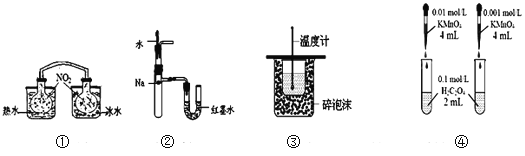
A. 装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)![]() N2O4(g)平衡移动的方向
N2O4(g)平衡移动的方向
B. 装置②依据U管两边液面的高低判断Na和水反应的热效应
C. 装置③测定中和热
D. 装置④依据褪色快慢比较浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
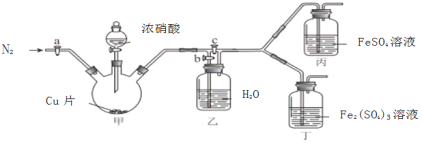
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C3H6O2, 其1H核磁共振谱如下图,则该有机物的结构简式为( )
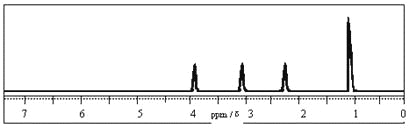
A. CH3COOCH3B. HCOOC2H5
C. CH3COCH2OHD. CH3CH(OH)CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
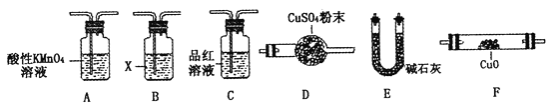
【题目】工业上常用铁质容器盛装冷浓硫酸。某学习小组为研究铁质材料与热浓硫酸的反应,设计了以下探究活动:
称取铁钉(碳素钢)6.0 g放入15.0 mL浓硫酸中,加热,充分应后得到溶液M并收集到气体N。
(1)该小组通过认真分析,认为M溶液中既含有Fe3+,也可能含有Fe2+。若确认溶液中有无Fe2+,应加入的试剂是___________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.NaOH溶液 d.酸性KMnO4溶液
(2)取320 mL(标准状况)气体N通入足量溴水中,然后加入足量BaCl2溶液,经过____________ 、______________(填操作名称)、干燥后,得到固体2.33 g。气体N与溴水反应的化学方程式为_______________,计算推知气体N中SO2的体积分数为_______________。
(3)该小组通过对铁钉的成分和SO2体积分数的分析,认为气体N中还可能含有H2和另外一种气体Q。你认为Q应该是_____________,理由是________________(用化学方程式表示)。
(4)取一定量N,利用下列仪器设计一个能同时检验N中含有H2和气体Q的装置(夹持仪器、橡胶管和加热装置省略),仪器的连接顺序是_____________(填字母),其中A的作用是_____________,B中试剂X的化学式是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com