
【题目】铁元素是重要的金属元素,铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素具有氧化性也有还原性的物质是_________。
a.铁单质 b.氯化亚铁 c.铁红 d.Fe3O4
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:____ Fe(OH)3+___ ClO-+_______=____FeO42-+____Cl-+______
(3)电子工业上用氯化铁腐蚀铜箔,制造印刷电路板,并从使用过的腐蚀废液(含有FeCl2、CuCl2、FeCl3)中回收铜,并获得氯化铁晶体,其工艺流程如下:回答下列问题:
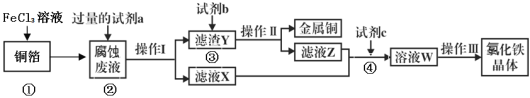
①反应①的化学方程式:_______________;
②从反应①和②可以判断出Fe2+、Cu2+、Fe3+的氧化性从强到弱顺序为:____________;
③操作I用到的玻璃仪器有烧杯、玻璃棒和___________;
④滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为:___________________。
【答案】BD 2 3 4OH- 2 3 5H2O 2FeCl3+Cu═2FeCl2+CuCl2 Fe3+>Cu2+>Fe2+ 漏斗 2Fe2++Cl2═2Fe3++2Cl-
【解析】
腐蚀液中含有FeCl2、CuCl2,分离难溶性固体和溶液采用过滤方法,所以操作I为过滤;向腐蚀液中加入过量的试剂a,得到滤渣Y和滤液X,加入的a为Fe,滤渣Y为Cu、Fe,滤液X为FeCl2,向滤渣Y中加入试剂b为稀盐酸,然后过滤得到Cu和滤液Z,Z中含有FeCl2和过量稀盐酸,然后加入试剂c,应该加入氯水,将FeCl2氧化为FeCl3,最后将溶液W蒸发浓缩、冷却结晶、过滤得到氯化铁晶体,以此解答。
(1)铁单质是0价;氯化亚铁是二价铁;铁红是三价铁;Fe3O4 既有三价铁也有二价铁;铁元素具有氧化性也有还原性的物质中,铁元素的化合价是中间价态,正确答案是BD;
(2)Fe(OH)3中铁是+3价,K2FeO4中铁元素是+6价,制备K2FeO4需要和氧化剂ClO-反应,根据得失电子守恒和原子守恒可以配平方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O ;
(3)①反应①中FeCl3和铜反应生成氯化亚铁和氯化铜,方程式为:2FeCl3+Cu═2FeCl2+CuCl2;
②反应①2FeCl3+Cu═2FeCl2+CuCl2中Fe3+是氧化剂,Cu2+是氧化产物,则氧化性:Fe3+>Cu2+;反应②为Fe+ Cu2+= Fe2++Cu,该反应中Cu2+是氧化剂,Fe2+是氧化产物,则氧化性: Cu2+>Fe2+,Fe2+、Cu2+、Fe3+的氧化性从强到弱顺序为:Fe3+>Cu2+>Fe2+;
③操作I为过滤,用到的玻璃仪器有烧杯、玻璃棒和漏斗;
④由分析可知滤液X、Z中都有同一种溶质FeCl2,应该加入氯水,将FeCl2氧化为FeCl3,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
![]()
A. 若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B. 若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C. 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D. 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸。某学习小组为研究铁质材料与热浓硫酸的反应,设计了以下探究活动:
称取铁钉(碳素钢)6.0 g放入15.0 mL浓硫酸中,加热,充分应后得到溶液M并收集到气体N。
(1)该小组通过认真分析,认为M溶液中既含有Fe3+,也可能含有Fe2+。若确认溶液中有无Fe2+,应加入的试剂是___________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.NaOH溶液 d.酸性KMnO4溶液
(2)取320 mL(标准状况)气体N通入足量溴水中,然后加入足量BaCl2溶液,经过____________ 、______________(填操作名称)、干燥后,得到固体2.33 g。气体N与溴水反应的化学方程式为_______________,计算推知气体N中SO2的体积分数为_______________。
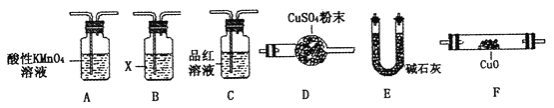
(3)该小组通过对铁钉的成分和SO2体积分数的分析,认为气体N中还可能含有H2和另外一种气体Q。你认为Q应该是_____________,理由是________________(用化学方程式表示)。
(4)取一定量N,利用下列仪器设计一个能同时检验N中含有H2和气体Q的装置(夹持仪器、橡胶管和加热装置省略),仪器的连接顺序是_____________(填字母),其中A的作用是_____________,B中试剂X的化学式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2种常见元素组成的化合物G,有关转化和实验信息如下:
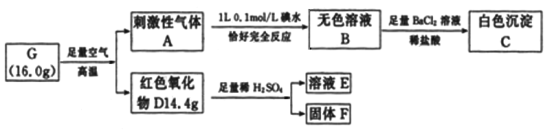
请回答下列问题:
(1)G是______________(填化学式)。
(2)写出A→B的离子方程式_____________________________________________。
(3)若D为纯净物,F是红色金属单质,写出D和稀硫酸反应的离子方程式_____________。
(4)C的最大质量为________________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
A. Na![]() Na2O
Na2O![]() Na2CO3
Na2CO3
B. Al![]() Al2O3
Al2O3![]() Al(OH)3
Al(OH)3
C. Fe(OH)2![]() Fe(OH)3
Fe(OH)3![]() Fe2O3
Fe2O3
D. Na2CO3(aq)![]() NaHCO3
NaHCO3![]() CO2
CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列判断正确的是( )
A.NA个O2和28g N2所占的体积都约为22.4 L
B.标准状况下,22.4 L H2O含有NA个水分子
C.71g Cl2与足量NaOH溶液反应,转移的电子数为2NA
D.1.8g的NH4+ 离子中含有的电子数NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:
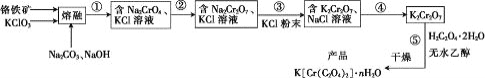
回答下列问题:
(1)“熔融”的装置如图,坩埚W的材质可以是________(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为_______________。
(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为________,“调pH为7~8,加热煮沸半小时”的目的是__________。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为________。
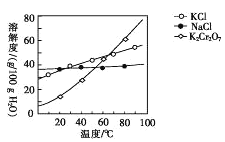
(4)步骤④包含的具体操作有____,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)
(5)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是________。
(6)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将pH=l的盐酸平均分成2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为____。
(2)在100℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为___
(3)在250C时,有pH为a的盐酸和pH为b的NaOH溶液,取Va L该盐酸,同该NaOH溶液中和,需Vb LNaOH溶液。填空:
①若a + b = 14,则Va∶Vb = __(填数字)。
②若a + b = 13,则Va∶Vb = ___(填数字)。
③若a + b >14,则Va∶Vb = ___(填表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,一定量的二氧化硫与1.100mol氧气在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A. 三氧化硫生成的速率与二氧化硫消耗的速率相等时反应达到平衡
B. 降低温度,正反应速率减小,逆反应速率增大
C. 平衡混合气体通入过量氯化钡溶液中,得到沉淀的质量为161.980g
D. 达到平衡时,二氧化硫的转化率为90%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com