
【题目】(1)将pH=l的盐酸平均分成2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为____。
(2)在100℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为___
(3)在250C时,有pH为a的盐酸和pH为b的NaOH溶液,取Va L该盐酸,同该NaOH溶液中和,需Vb LNaOH溶液。填空:
①若a + b = 14,则Va∶Vb = __(填数字)。
②若a + b = 13,则Va∶Vb = ___(填数字)。
③若a + b >14,则Va∶Vb = ___(填表达式)。
【答案】11:1 1:10 1 0.1 10a+b-14
【解析】
此题为溶液pH的计算,涉及两种题型,一种为溶液的稀释,另一种为酸碱溶液的混合,计算时前者根据溶质的物质的量不变,后者计算反应后剩余的酸的物质的量和溶液的体积进行计算.由稀释规律知,1份pH=1的盐酸升高pH=2时所加水应该约为9份;设加NaOH溶液x份,则盐酸与NaOH溶液(据题意知其浓度应为0.1 molL-1)反应后仍有盐酸剩余,即得加入的水与NaOH溶液的体积比;
25℃时水的离子积Kw=c(H+)×c(OH-)=10-14,pH= -lgc(H+);25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸用该NaOH溶液中和,需VbLNaOH溶液,则有Va L×10-amol/L=Vb L×10b-14mol/L;根据Va L×10-amol/L=Vb L×10b-14mol/L,即Va:Vb=10a+b-14,以此进行解答。
(1)根据题意盐酸平均分成2份,设每份都为1L,将pH= 1的盐酸加适量的水, pH升高1,则体积是原盐酸体积的10倍,说明所加的水的体积是原溶液的9倍,即水的体积为9L ;另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH也升高了1,可设碱液体积x,依题意可列出下列等式:10-1mol/L×1L-10-1mol/L×xL= 10-2mol/L×(1+x)L,解之得x=![]() L ,则加入的水与NaOH溶液的体积比为9:
L ,则加入的水与NaOH溶液的体积比为9:![]() =11:1;
=11:1;
(2)pH=3的硫酸溶液的H+浓度为10-3,pH=10的NaOH的OH-浓度为10-4,故若使混合后溶液的pH=7,则硫酸溶液和NaOH溶液两者中和反应需要物质的量相等,因此体积比为应为1:10;
(3)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取Va L该盐酸用该NaOH溶液中和,需Vb LNaOH溶液,则有Va L×10-amol/L=Vb L×10b-14mol/L,即Va:Vb=10a+b-14,
①若a+b=14,则Va:Vb=10a+b-14=1;
②若a+b=13,则Va:Vb=10a+b-14=1:10=0.1;
③若a+b>14,则Va:Vb=10a+b-14>1,即Va>Vb。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为_____检验溶液中还有Fe3+的试剂是_____
(2)工业上制取漂白粉的化学反应方程式为_____除去氯气中混有的氯化氢气体的方法是将气体通过_____溶液中。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为_____
(4)在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g。此混合物中CO和CO2物质的量之比是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素是重要的金属元素,铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素具有氧化性也有还原性的物质是_________。
a.铁单质 b.氯化亚铁 c.铁红 d.Fe3O4
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:____ Fe(OH)3+___ ClO-+_______=____FeO42-+____Cl-+______
(3)电子工业上用氯化铁腐蚀铜箔,制造印刷电路板,并从使用过的腐蚀废液(含有FeCl2、CuCl2、FeCl3)中回收铜,并获得氯化铁晶体,其工艺流程如下:回答下列问题:
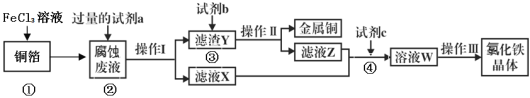
①反应①的化学方程式:_______________;
②从反应①和②可以判断出Fe2+、Cu2+、Fe3+的氧化性从强到弱顺序为:____________;
③操作I用到的玻璃仪器有烧杯、玻璃棒和___________;
④滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
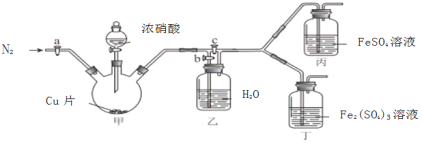
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)时一种重要的化学试剂,通常条件下为棕色易水解的固体。某小组在实验室制备氮化钙并测定其纯度,设计如下实验
Ⅰ.氮化钙的制备。
(1)加热条件下,钙和氮气制备氮化钙的反应方程式为______。
(2)钙和氮气制备氮化钙的装置如下(夹持装置略去):

上述装置合理的连接顺序为______(按气流方向,用接口字母表示,装置不重复使用)。
(3)按连接好的装置进行实验。
①实验步骤如下:检查装置气密性、加入药品:______ (请按正确顺序填入下列步骤的字母标号)。
a.点燃装置C处酒精灯,反应一段时间
b.打开分液漏斗活塞
c.点燃装置A处酒精灯
d.熄灭装置A处酒精灯
e.熄灭装置C处酒精灯
f.关闭分液漏斗活塞
②装置B的作用为______。
③装置C的硬质玻璃管中的现象为______
(4)设计实验证明Ca3N2中混有钙单质:______
Ⅱ.测定氮化钙纯度
ⅰ称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1.00mol/L的盐酸中,充分反应后,将所得溶液稀释到200.00mL;
ii.取20.00mL稀释后的溶液,用0.2mol/LNaOH标准溶液滴定过量的盐酸,到终点时消耗标准溶液25.00mL。
(5)所取固体中氮化钙的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C3H6O2, 其1H核磁共振谱如下图,则该有机物的结构简式为( )
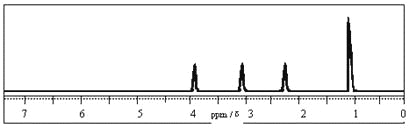
A. CH3COOCH3B. HCOOC2H5
C. CH3COCH2OHD. CH3CH(OH)CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
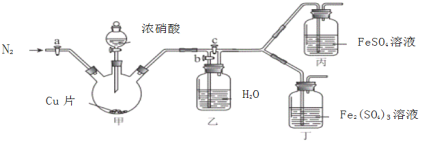
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的废水中含有氰化物,可在碱性条件下对氰化物进行净化处理:2CN-+8OH- +5C12=2CO2+N2+10Cl-+4H2O。下列分析中错误的是( )
A.当反应消耗0.2 mol CN-时,反应中转移电子的物质的量是1 mol
B.还原性:CN->Cl-
C.CN-的电子式为![]()
D.该反应中氧化剂和还原剂的物质的量之比是2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)三种金属与同浓度盐酸反应,反应最慢的是___(填选项)。
a.钠 b.铝 c.铁
(2)金属钠与水发生反应的离子方程式为___;(填选项)
a.2Na +2H2O=2NaOH+H2↑
b.2Na+2H2O=2Na++2OH-+H2↑
c.2Na +2H2O=2Na++2OH-+O2↑
(3)可观察到的实验现象正确的是__(填选项)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(4)填写a、b、c化学式并书写①的化学方程式(a、b、c均为含Al化合物);
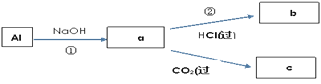
a:___,b:___,c:___;
①____________;
(5)Fe跟Cl2在一定条件下反应,所得产物为___。
(6)将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,产生__色沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com