
����Ŀ�������ƣ�Ca3N2��ʱһ����Ҫ�Ļ�ѧ�Լ���ͨ��������Ϊ��ɫ��ˮ��Ĺ��塣ijС����ʵ�����Ʊ������Ʋ��ⶨ�䴿�ȣ��������ʵ��
�����Ƶ��Ʊ���
��1�����������£��ƺ͵����Ʊ������Ƶķ�Ӧ����ʽΪ______��
��2���ƺ͵����Ʊ������Ƶ�װ�����£��г�װ����ȥ����

����װ�ú���������˳��Ϊ______�������������ýӿ���ĸ��ʾ��װ�ò��ظ�ʹ�ã���
��3�������Ӻõ�װ�ý���ʵ�顣
��ʵ�鲽�����£����װ�������ԡ�����ҩƷ��______ ���밴��ȷ˳���������в������ĸ��ţ���
a����ȼװ��C���ƾ��ƣ���Ӧһ��ʱ��
b����Һ©������
c����ȼװ��A���ƾ���
d��Ϩ��װ��A���ƾ���
e��Ϩ��װ��C���ƾ���
f���رշ�Һ©������
��װ��B������Ϊ______��
��װ��C��Ӳ�ʲ������е�����Ϊ______
��4�����ʵ��֤��Ca3N2�л��иƵ��ʣ�______
�ⶨ�����ƴ���
����ȡ4.0g��Ӧ��Ĺ��壬��������ˮ�������ɵ�����ȫ��������ͨ��100.00mL 1.00mol/L�������У���ַ�Ӧ��������Һϡ�͵�200.00mL��
ii��ȡ20.00mLϡ�ͺ����Һ����0.2mol/LNaOH����Һ�ζ����������ᣬ���յ�ʱ���ı���Һ25.00mL��
��5����ȡ�����е����Ƶ���������Ϊ______��
���𰸡�3Ca+N2![]() Ca3N2 i��gh��ab��ef��jk��d cbaefd ��ֹ����������װ��CʹCa3N2���� ����ɫ������Ϊ��ɫ ȡC�з�Ӧ������������Թ��У�������ϡ���ᣨ��ˮ��������������ͨ����ʯ�ң���Ũ���ᣩ��ͨ�����ȵ�CuO����ɫ�����죬��Ca3N2�л��иƵ��� 92.5%
Ca3N2 i��gh��ab��ef��jk��d cbaefd ��ֹ����������װ��CʹCa3N2���� ����ɫ������Ϊ��ɫ ȡC�з�Ӧ������������Թ��У�������ϡ���ᣨ��ˮ��������������ͨ����ʯ�ң���Ũ���ᣩ��ͨ�����ȵ�CuO����ɫ�����죬��Ca3N2�л��иƵ��� 92.5%
��������
���ڵ�������ˮ�⣬�����ø���ĵ�����Ʒ�Ӧ�Ʊ������ƣ��������װ�ú��Լ����������ÿ����ṩ��Ӧ���赪�������ڸ���������е�������ˮ�����ȷ�Ӧ������Ҫ�ȳ�ȥ�����е�������ˮ�����ȣ�ͬʱΪ��ֹ������ˮ�⣬ʵ����Ҫ��ֹ���ˮ��������װ���У��ݴ˷�������
��1������ʱ��������Ʒ�Ӧ���ɵ����ƣ���Ӧ����ʽΪ3Ca+N2![]() Ca3N2��
Ca3N2��
�ʴ�Ϊ��3Ca+N2![]() Ca3N2��
Ca3N2��
��2���������װ�ú��Լ����������ÿ����ṩ��Ӧ���赪�������ڸ���������е�������ˮ�����ȷ�Ӧ������ͨ��Dװ�ó������е�ˮ�������������壬��Aװ�������ȵ����۳������е���������Cװ���е�����Ca��Ӧ���ɵ����ƣ����ڵ�������ˮ�⣬Bװ������Ũ�����ֹ������ˮ��������C�е�Ӳ�ʲ������У�C��B֮���Fװ�÷�ֹ���������������������˳���ǣ�i��gh��ab��ef��jk��d��
�ʴ�Ϊ��i��gh��ab��ef��jk��d��
��3����ʵ�鿪ʼ���װ�������ԡ�����ҩƷ���ȵ�ȼװ��A���ƾ��ƣ��Ա�֤��Ca��Ӧ������ֻ�е���������Һ©����������ȼװ��C���ƾ��ƣ���Ӧһ��ʱ�䡢Ϩ��װ��C���ƾ��ơ��رշ�Һ©�����������Ϩ��װ��A���ƾ��ƣ������Ƶõ����ƣ������˳��Ϊcbaefd��
�ʴ�Ϊ��cbaefd��
��װ��B��ʢװ��Ũ����������ˮ��������ֹ����������װ��CʹCa3N2���ʣ�
�ʴ�Ϊ����ֹ����������װ��CʹCa3N2���ʣ�
��װ��C�е������ڼ������������ɵ����ƣ��ɹ۲쵽������Ϊ����ɫ������Ϊ��ɫ��
�ʴ�Ϊ������ɫ������Ϊ��ɫ��
��4��Ca��Ca3N2���������ᣨ��ˮ����Ӧ�����ᣨ��ˮ����Ca��Ӧ���ɵ�H2��ʹ��ɫ��CuO��죬�������������ᣨ������ˮ����Ӧû�������������֤��Ca3N2�л��иƵ��ʵ�ʵ�鲽��Ϊ��ȡC�з�Ӧ������������Թ��У�������ϡ���ᣨ��ˮ���������������ü�ʯ�Ҹ����ͨ�����ȵ�CuO����ɫ�����죬��Ca3N2�л��иƵ��ʡ�
�ʴ�Ϊ��ȡC�з�Ӧ������������Թ��У�������ϡ���ᣨ��ˮ��������������ͨ����ʯ�ң���Ũ���ᣩ��ͨ�����ȵ�CuO����ɫ�����죬��Ca3N2�л��иƵ��ʣ�
��5��ʣ���������Ϊ![]() ��0.2mol/L��0.025L=0.05mol������NH3��Ӧ������Ϊ0.1L��1mo/L-0.05mol=0.05mol�����ݵ�Ԫ���غ㣺Ca3N2��2NH3~2HCl����n��Ca3N2��=0.025mol�����Ƶ���������Ϊ
��0.2mol/L��0.025L=0.05mol������NH3��Ӧ������Ϊ0.1L��1mo/L-0.05mol=0.05mol�����ݵ�Ԫ���غ㣺Ca3N2��2NH3~2HCl����n��Ca3N2��=0.025mol�����Ƶ���������Ϊ![]() ��100%=92.5%��
��100%=92.5%��
�ʴ�Ϊ��92.5%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����������η���E��ֱ���η���G��Ӧ�������������η���L��ֱ���η���M(���E���ӵ�Ԫ�ص�ԭ��������С��10�����G���ӵ�Ԫ��Ϊ��������Ԫ��)�������ж�����ȷ����(����)
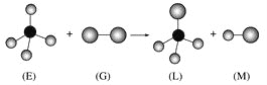
A. ���³�ѹ�£�L��һ��Һ̬�л���
B. E�Ķ������ֻ�����ֽṹ
C. G����ǿ�����Ժ�Ư����
D. ������Ӧ��������ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ת���ڸ�����������ʵ�ֵ���
A. Na![]() Na2O
Na2O![]() Na2CO3
Na2CO3
B. Al![]() Al2O3
Al2O3![]() Al(OH)3
Al(OH)3
C. Fe(OH)2![]() Fe(OH)3
Fe(OH)3![]() Fe2O3
Fe2O3
D. Na2CO3(aq)![]() NaHCO3
NaHCO3![]() CO2
CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����(��FeO��Cr2O3��Al2O3��SiO2��)Ϊԭ���Ʊ���������ص�ʵ�鲽����ͼ��
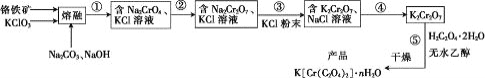
�ش��������⣺
(1)����������װ����ͼ������W�IJ��ʿ�����________(�����������մ�������������)��FeO��Cr2O3��KClO3��Na2CO3������Ӧ������Fe2O3��KCl��Na2CrO4��CO2�Ļ�ѧ����ʽΪ_______________��
(2)���ں�Ĺ����к�Na2CrO4��Fe2O3��Na2SiO3��NaAlO2��KCl�ȣ�����ٵľ��岽��Ϊˮ�������ˣ���pHΪ7~8��������а�Сʱ�����ȹ��ˡ���һ�ι��������е���Ҫ�ɷ�Ϊ________������pHΪ7~8��������а�Сʱ����Ŀ����__________��
(3)�����������ᣬ�����ϡ����ʱ������Ӧ�����ӷ���ʽΪ________��
(4)����ܰ����ľ��������____��������õ�K2Cr2O7���塣(�й����ʵ��ܽ��������ͼ��ʾ)
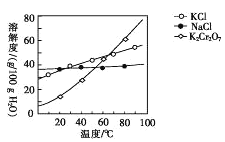
(5)������������ֹ��������м���һ��ˮ�������ƾ���ĥ�����õĹ�������������������________��
(6)�������ط������ⶨK[Cr(C2O4)2]��nH2O��Ʒ�����ᾧˮ��Ŀ������Ʒ���ȵ�80��ʱ��ʧ��ȫ���ᾧˮ��ʧ��16.8%��K[Cr(C2O4)2]��nH2O������n=____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ������Ҫ�Ľ���Ԫ�أ������仯�������ճ�����������Ӧ�ù㷺���о������仯�����Ӧ�������ش�
��1��������Ԫ�ؾ���������Ҳ�л�ԭ�Ե�������_________��
a�������� b���Ȼ����� c������ d��Fe3O4
��2��������أ�K2FeO4����һ�����͡���Ч�������ɫˮ��������ʪ���Ʊ�������أ�K2FeO4���ķ�Ӧ��ϵ������������Fe(OH)3��C1O����OH����FeO42����Cl����H2O��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ:____ Fe(OH)3+___ ClO��+_______=____FeO42��+____Cl��+______
��3�����ӹ�ҵ�����Ȼ�����ʴͭ��������ӡˢ��·�壬����ʹ�ù��ĸ�ʴ��Һ������FeCl2��CuCl2��FeCl3���л���ͭ��������Ȼ������壬�乤���������£��ش���������:
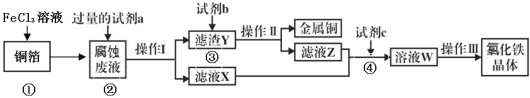
�ٷ�Ӧ�ٵĻ�ѧ����ʽ��_______________��
�ڴӷ�Ӧ�ٺ͢ڿ����жϳ�Fe2+��Cu2+��Fe3+�������Դ�ǿ����˳��Ϊ��____________��
�۲���I�õ��IJ����������ձ�����������___________��
����ҺX��Z�ж���ͬһ�����ʣ�����ת��Ϊ��ҺW�����ӷ���ʽΪ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����pH=l������ƽ���ֳ�2�ݣ�l�ݼ�����ˮ����1�ݼ�������������ʵ���Ũ����ͬ������NaOH��Һ��pH��������1��������ˮ��NaOH��Һ�������Ϊ____��
��2����100���£���pH=3��������Һ��pH=10��NaOH��Һ��ϣ���Ҫʹ��Ϻ���Һ��pH=7����������Һ��NaOH��Һ�������ԼΪ___
��3����250Cʱ����pHΪa�������pHΪb��NaOH��Һ��ȡVa L�����ᣬͬ��NaOH��Һ�кͣ���Vb LNaOH��Һ����գ�
����a + b = 14����Va��Vb = __�������֣���
����a + b = 13����Va��Vb = ___�������֣���
����a + b ��14����Va��Vb = ___�������ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к͵ζ����ⶨij�ռ���Ʒ�Ĵ��ȣ������²��裺
��1�����ƴ���Һ����5.00g�����������ʣ����ʲ������ᷴӦ���Ĺ����ռ���Ʒ����1000mL��Һ�����ձ�����ͷ�ιܡ��������⣬����Ҫ�IJ��������� ______ ��
��2�����
��ʢװ0.1000molL-1�����ҺӦ��ʹ�� ______ ʽ�ζ��ܣ��ζ�ʱ������Ӧ�����ӷ���ʽΪ�� ______ ��
���й����ݼ�¼���£�
�ⶨ��� | ������Һ�����/mL | ���������Һ�����/mL | |
�ζ�ǰ | �ζ��� | ||
1 | 20.00 | 0.50 | 20.78 |
2 | 20.00 | 1.20 | 21.32 |
3 | 20.00 | 0.80 | 23.20 |
��3�����㣺�ռ���Ʒ�Ĵ����� ______ ��
��4����������ѡ����ƫ������ƫ����������Ӱ��������
��������ˮ��ϴ��ƿ�����ʹ�ⶨ��� ______ ��
�ڶ���ʱ���ζ�ǰ���ӣ��ζ����ӣ����ʹ�ⶨ��� ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ,�ش���������:
��1����12.5g CuSO4��5H2O����ˮ���γ�1L��Һ�����ʵ����ʵ���Ũ��Ϊ_________mol��L��1
��2����ԭ�ӵ����ʵ��������������HCl��H2��NH3��CH4����ͬ��ͬѹ�£��������������֮��V(HCl)��V(H2)��V(NH3)��V(CH4)=______________��
��3������100mL 1.00 mol��L��1H2SO4��Һ����Ҫ����Ͳ��ȡŨ���ᣨ�ܶ�Ϊ1.84g��cm��3��������������Ϊ98%�������Ϊ_____________mL��
��4����Ӧ2K2S+ K2SO3+3H2SO4=3S��+3 K2SO4+3H2O�У��������뻹ԭ�������ʵ���֮��Ϊ______������Ӧ����0.6molS����Ӧ��ת�Ƶĵ���Ϊ____________mol��
��5����������5�����ʣ���CO2 ��Mg ������ ��NaCl ��Na2CO3�������������ڵ���ʵ���_____________������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ�ֲ�����ˮ�Ĺ���ǽ������������ͼ�е�ת����ϵ���ش�
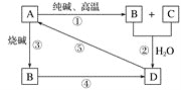
��1��A��______��B��_____��D��_____��
��2��д��ѧ����ʽ��
��_________��
��_________��
��3��д���ӷ���ʽ��
��__________��
��________��
��________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com