
【题目】用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用5.00g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液,除烧杯、胶头滴管、玻璃棒外,还需要的玻璃仪器有 ______ 。
(2)滴定:
①盛装0.1000molL-1盐酸标准液应该使用 ______ 式滴定管,滴定时发生反应的离子方程式为: ______ 。
②有关数据记录如下:
测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.78 |
2 | 20.00 | 1.20 | 21.32 |
3 | 20.00 | 0.80 | 23.20 |
(3)计算:烧碱样品的纯度是 ______ 。
(4)误差分析(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果 ______ ;
②读数时,滴定前仰视,滴定后俯视,则会使测定结果 ______ 。
【答案】1000mL容量瓶 酸式 H++OH-=H2O 80.8% 无影响 偏低
【解析】
1)配制1000mL一定物质的量浓度的氢氧化钠溶液需要仪器:1000mL容量瓶、胶头滴管、烧杯、玻璃棒、天平、药匙,所以配制待测液需要的玻璃仪器有1000mL容量瓶、玻璃棒、胶头滴管,烧杯;
故答案为:1000mL容量瓶;
(2)盛装0.1000molL-1盐酸标准液应该使用酸式滴定管,反应的离子方程式为:H++OH-=H2O;
故答案为:酸式; H++OH-=H2O;
(3)三次消耗盐酸体积分别为:20.78mL-0.50mL=20.28mL、21.32mL-1.20mL=20.12mL、23.20mL-0.8mL=22.4mL(误差较大,舍去),两次消耗盐酸的平均体积为20.20mL,
NaOH~~~~~HCl
1 1
n(NaOH) 0.1000molL-1×20.20mL
n(NaOH)=0.00202mol,即20.00mL待测溶液含有m(烧碱)=nM=0.00202mol×40g/mol=0.0808g,所以1000mL待测溶液含有m(烧碱)=0.0808g×50=4.04g,烧碱的纯度ω(烧碱)=![]() ×100%=80.8%,
×100%=80.8%,
故答案为:80.8%;
(4)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量,不会影响测定结果;
②读数时,滴定前仰视,滴定后俯视,盐酸体积变小,结果偏低;
故答案为:无影响;偏低;


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】如图表示的是纯净物、单质、化合物、含氧化合物、氧化物、碱之间的包含、不包含关系,若整个大圆圈代表纯净物,则下列选项中,能正确指出①、②、③、④、⑤所属物质类别的是( )
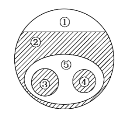
A. ①单质、③化合物
B. ②碱、⑤氧化物
C. ④碱、⑤含氧化合物
D. ④含氧化合物、③氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、HCO3-、S2-、SO42-、Cl-、OH-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
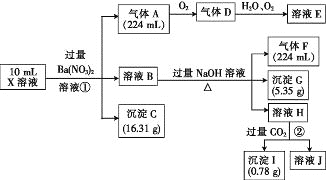
(1)通过上述实验过程,一定不存在的离子是_______。
(2)反应①中生成A的离子方程式为________。
(3)若测得X溶液中c(H+)=6mol·L-1,则X溶液中_______(填“含”或“不含”)Fe3+,c(Fe3+)=________mol·L-1(若填不含,则不需计算),X溶液中c(Cl-)=_______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)时一种重要的化学试剂,通常条件下为棕色易水解的固体。某小组在实验室制备氮化钙并测定其纯度,设计如下实验
Ⅰ.氮化钙的制备。
(1)加热条件下,钙和氮气制备氮化钙的反应方程式为______。
(2)钙和氮气制备氮化钙的装置如下(夹持装置略去):

上述装置合理的连接顺序为______(按气流方向,用接口字母表示,装置不重复使用)。
(3)按连接好的装置进行实验。
①实验步骤如下:检查装置气密性、加入药品:______ (请按正确顺序填入下列步骤的字母标号)。
a.点燃装置C处酒精灯,反应一段时间
b.打开分液漏斗活塞
c.点燃装置A处酒精灯
d.熄灭装置A处酒精灯
e.熄灭装置C处酒精灯
f.关闭分液漏斗活塞
②装置B的作用为______。
③装置C的硬质玻璃管中的现象为______
(4)设计实验证明Ca3N2中混有钙单质:______
Ⅱ.测定氮化钙纯度
ⅰ称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1.00mol/L的盐酸中,充分反应后,将所得溶液稀释到200.00mL;
ii.取20.00mL稀释后的溶液,用0.2mol/LNaOH标准溶液滴定过量的盐酸,到终点时消耗标准溶液25.00mL。
(5)所取固体中氮化钙的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铁生锈的过程为:Fe→Fe(OH)2→Fe(OH)3→Fe2O3xH2O.又知草酸(H2C2O4)分解的化学方程式为 H2C2O4![]() CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲同学利用草酸分解产生的混合气体和如所示装置测定其中一种锈铁的组成。
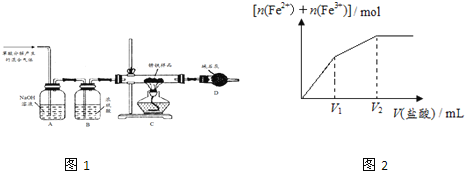
主要操作为:取锈铁样品12.6g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4g,装置D增重8.4g。
①钢铁在潮湿空气中发生电化学腐蚀时,其负极的电极反应式为 ______ 。
②装置A的作用是 ______ ,装置B的作用是 ______ 。
③根据以上数据能否测定出锈铁的组成?答: ______ (填“能”或“不能”)。
④该装置还存在的一个明显的缺陷是 ______ 。
(2)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4g,而装置E增重1.8g,则x= ______ ;m(Fe):m (Fe2O3xH2O)= ______ 。
(3)丙同学取少量的另外一种锈铁片放在烧杯中,然后逐滴加入稀盐酸,实验测知所得溶液中Fe2+、Fe3+的物质的量之和与加入稀盐酸的体积关系如图2示,此锈铁中n(Fe):n(Fe2O3xH2O)的取值范围是 ______ 。(填字母)
a.大于1 b.等于1 c.小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
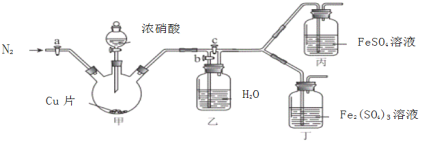
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有O22-的物质通常接有较强的氧化化性,一定条件下也可表现出还原性等,在现代工业及生活中有着重要的用途。
(1)过氧化钙可用作鱼苗长途运输中的供氧剂、消毒剂,写出过氧化钙的电子式:______,用化学方程式表示出它作供氧剂的原理:______。
(2)过氧化氢能氧化许多物质,也能被多种常见物质催化分解。
①向20mL0.05molL-1的H2O2溶液中缓慢通入标准状况下22.4mLSO2(忽略溶液体积的变化),充分反应后再加入几滴甲基橙试剂,溶液变红,则反应后溶液的pH为______。
②为证明MnO2能催化H2O2的分解,同学甲设计了如图所示的装置进行实验:
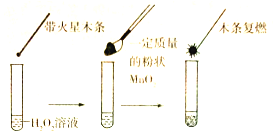
但乙同学认为,仅凭此实验不能确认MnO2是该反应的催化剂,他作出此判断的理由可能是______。
③FeCI3可催化H2O2的分解,其催化机理分为两个阶段,相应反应的化学方程式可表示为:
(i)2FeCl3+H2O2=2FeCl2+O2↑+2HCl。
(ii)______。
若在实验中加入几滴______,则能证明反应过程中确有Fe2+生成。
(3)过硫酸钠(Na2S2O8,有一个过氧根)其有强氧化性,Na2S2O8中硫元素的化合价为______,向Na2S2O8溶液中加入MnSO4后可得到紫色溶液,则此反应中氧化剂与氧化产物的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列方案可以提高尾气处理效率的是( )
N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③增大装置的压强 ④装置中放入碱石灰
A. ①③④ B. ①②③ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所选择的装置或操作正确的是( )
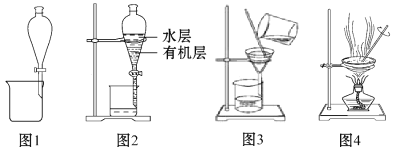
A.用图1所示的装置可以实现用酒精提取溴水中的Br2
B.用图2所示的装置分层时,两层液体先后从下口出
C.粗盐提纯,除去沉淀和泥沙等杂质时,选图3所示的装置
D.NaCl溶液蒸发结晶时,选图4所示的装置,至蒸发皿中晶体全部析出时再停止加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com