
����Ŀ����֪������Ĺ���Ϊ��Fe��Fe��OH��2��Fe��OH��3��Fe2O3xH2O����֪���ᣨH2C2O4���ֽ�Ļ�ѧ����ʽΪ H2C2O4![]() CO��+CO2��+H2O��ij��ѧС��Ϊ�ⶨ���ֲ�ͬ������Ƭ����ɣ���ֻ��������Fe2O3xH2O��������������̽����������벢��ɶ��й�����Ľ��
CO��+CO2��+H2O��ij��ѧС��Ϊ�ⶨ���ֲ�ͬ������Ƭ����ɣ���ֻ��������Fe2O3xH2O��������������̽����������벢��ɶ��й�����Ľ��
��1����ͬѧ���ò���ֽ�����Ļ�����������ʾװ�òⶨ����һ����������ɡ�
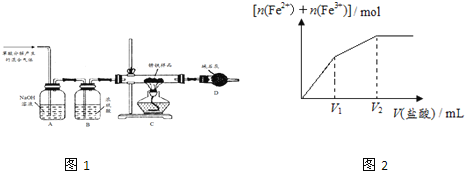
��Ҫ����Ϊ��ȡ������Ʒ12.6g����װ��C��Ӳ�ʲ������У�������ȫ��Ӧ��õ����������Ϊ8.4g��װ��D����8.4g��
�ٸ����ڳ�ʪ�����з����绯ѧ��ʴʱ���为���ĵ缫��ӦʽΪ ______ ��
��װ��A�������� ______ ��װ��B�������� ______ ��
�۸������������ܷ�ⶨ����������ɣ��� ______ ������������������������
�ܸ�װ�û����ڵ�һ�����Ե�ȱ���� ______ ��
��2����ͬѧ�ڼ�ͬѧװ�õĻ����Ͻ�װ��D����װŨ�����ϴ��ƿ��װ��E����װ��ͼ�ԣ������Ľ������°���ͬѧ�IJ�������Ʒȡ��������ʵ�飬����ȫ��Ӧ��õ������������Ϊ8.4g����װ��E����1.8g����x= ______ ��m��Fe����m ��Fe2O3xH2O��= ______ ��
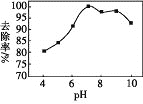
��3����ͬѧȡ����������һ������Ƭ�����ձ��У�Ȼ����μ���ϡ���ᣬʵ���֪������Һ��Fe2+��Fe3+�����ʵ���֮�������ϡ����������ϵ��ͼ2ʾ����������n��Fe����n��Fe2O3xH2O����ȡֵ��Χ�� ______ ��������ĸ��
a������1 b������1 c����1
���𰸡�Fe-2e-=Fe2+ ��ȥ��������е�CO2 ��ȥ��������е�H2O �� ȱ��β������װ�� 2 2��7 c
��������
����ֽ�õ���ˮ������CO��CO2�Ļ������Aװ���е�NaOH��ȥ������̼��Bװ���е�Ũ�������CO��Cװ����CO��ԭFe2O3��ͬʱFe2O3��xH2Oʧȥ�ᾧˮ��Dװ���м�ʯ������Cװ�������ɵ�CO2��H2O��g�����ݴ˷�������
��1���ٸ����ڳ�ʪ�����з����绯ѧ��ʴʱ��������ʧȥ���ӷ���������Ӧ�������ĵ缫��ӦʽΪFe-2e-=Fe2+��
�ʴ�Ϊ��Fe-2e-=Fe2+��
�ڸ���ʵ��Ŀ�ģ���Ҫʹ��һ����̼��ԭFe2O3��xH2O��������Ҫ������ֽ����ɵĶ�����̼��ˮ��ȥ��װ��A�е�����������Һ���ڳ�ȥ������̼���壬װ��B�е�Ũ�������ڸ���һ����̼���壬
�ʴ�Ϊ����ȥ��������е�CO2����ȥ��������е�H2O��
��������Ʒ12.6g��������ȫ��Ӧ��õ�������Ϊ8.4g�Ĺ���Ϊ������������������Ʒ����Ԫ�غ���Ԫ������֮��Ϊ12.6g-8.4g=4.2g����16g/mol��3n��Fe2O3��+18g/moln��H2O��=4.2g��װ��D����8.4gΪ������̼��ˮ����������Ϸ���ʽFe2O3��xH2O+3CO![]() 2Fe+3CO2+xH2O��44g/mol��3n��Fe2O3��+18g/moln��H2O��=8.4g�����n��Fe2O3��=0.05mol��n��H2O��=0.1mol����Fe2O3��xH2O�Ļ�ѧʽΪFe2O3��2H2O��������Ʒ�к�n��Fe2O3��2H2O��=0.05mol����n��Fe��=
2Fe+3CO2+xH2O��44g/mol��3n��Fe2O3��+18g/moln��H2O��=8.4g�����n��Fe2O3��=0.05mol��n��H2O��=0.1mol����Fe2O3��xH2O�Ļ�ѧʽΪFe2O3��2H2O��������Ʒ�к�n��Fe2O3��2H2O��=0.05mol����n��Fe��=![]() =0.05mol���ܲⶨ��������ɣ�
=0.05mol���ܲⶨ��������ɣ�
�ʴ�Ϊ���ܣ�
�ܸ�װ�õ�ȱ���ǣ�һ����̼�ж��������ŷŵ������У�����Ӧ������β������װ�ã�
�ʴ�Ϊ��ȱ��β������װ�ã�
��2������װ��D����װŨ�����ϴ��ƿ��װ��E�������°�������Ʒ�������Ͳ�������ʵ�飬����ȫ��Ӧ��õ������������Ϊ8.4g����������Ʒ����Ԫ�غ���Ԫ������֮��Ϊ12.6g-8.4g=4.2g��16g/mol��3n��Fe2O3��+18g/moln��H2O��=4.2g��װ��E����1.8g��n��H2O��=1.8g��18g/mol=0.1mol�����n��Fe2O3��=0.05mol��n��Fe2O3����n��H2O��=0.05mol��0.1mol=1:2����x=2��m��Fe2O3��xH2O��=0.05mol��160g/mol+1.8g=9.8g��m��Fe��=12.6g-9.8g=2.8g��m��Fe����m ��Fe2O3xH2O��= 2.8g��9.8g=2:7��
�ʴ�Ϊ��2��2��7��
��3��0��V1�Σ�������������ʱ�������ķ�ӦΪFe2O3+6HCl=2FeCl3+3H2O��Fe+2FeCl3=3FeCl2���ܷ�ӦΪ��Fe+Fe2O3+6HCl=3FeCl2+3H2O����Fe+2HCl=FeCl2+H2����֪��2mol�Ȼ�������1mol�������ӣ���Fe2O3+6HCl=2FeCl3+3H2O��֪��6mol���Ȼ����������2mol��Fe3+����Ȼ������ͬ���ʵ�������ʱ���������ᷴӦ���ӵ������������ʵ����������������ᷴӦ���ӵ����������ʵ���������V1��V2�����Ӻ����������ܵ����ʵ����������С��0��V1��˵��V1��V2��Ϊ������������ķ�Ӧ���������������ʵ��������������ʵ�������c��ȷ��
�ʴ�Ϊ��c��


 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڷ�Ӧ3BrF3��5H2O===HBrO3��Br2��9HF��O2���У�����5 mol H2O��Ϊ��ԭ��ʱ������ԭ��BrF3�����ʵ���Ϊ(����)
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ�����Ⱦ���Խ��Խ�ܵ����ǵ����ӡ��ش��������⣺
(1)�����£���pHԼΪ9ʱ���ó���ʯ��ˮ�ɽ�ˮ���е�HPO42-��ΪCa10(PO4)6(OH)2������ȥ���÷�Ӧ�����ӷ���ʽΪ_____________��
(2)��ȥ����ˮ�е���̬��ͨ���û�ԭ�����仹ԭΪN2��
��Prusse���������Pd-Cu�������������£���pHΪ4.0~6.0ʱ����ֱ����H2��NO3-��ԭΪN2���÷�Ӧ�����ӷ���ʽΪ__________���о�������H2��CO2�Ļ���������H2��NO3-��ȥ��Ч����ֻ��H2ʱ���ã���ԭ����________��
����pHԼΪ5ʱ��������Fe�ۿɽ�NO3-��ԭΪN2��Fe�۱�����ΪFe2+���÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ_________��
(3)ʵ������ͬ�����£��ô��������ѳ�ˮ���еİ�̬���Ĺ�����(2NH3+3ClO-=N2+3H2O+3Cl-)��pH�백̬����ȥ���ʹ�ϵ��ͼ��ʾ����pH����9ʱ��pHԽ��ȥ����ԽС����ԭ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ������Ҫ�Ľ���Ԫ�أ������仯�������ճ�����������Ӧ�ù㷺���о������仯�����Ӧ�������ش�
��1��������Ԫ�ؾ���������Ҳ�л�ԭ�Ե�������_________��
a�������� b���Ȼ����� c������ d��Fe3O4
��2��������أ�K2FeO4����һ�����͡���Ч�������ɫˮ��������ʪ���Ʊ�������أ�K2FeO4���ķ�Ӧ��ϵ������������Fe(OH)3��C1O����OH����FeO42����Cl����H2O��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ:____ Fe(OH)3+___ ClO��+_______=____FeO42��+____Cl��+______
��3�����ӹ�ҵ�����Ȼ�����ʴͭ��������ӡˢ��·�壬����ʹ�ù��ĸ�ʴ��Һ������FeCl2��CuCl2��FeCl3���л���ͭ��������Ȼ������壬�乤���������£��ش���������:
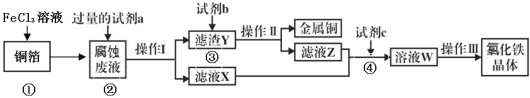
�ٷ�Ӧ�ٵĻ�ѧ����ʽ��_______________��
�ڴӷ�Ӧ�ٺ͢ڿ����жϳ�Fe2+��Cu2+��Fe3+�������Դ�ǿ����˳��Ϊ��____________��
�۲���I�õ��IJ����������ձ�����������___________��
����ҺX��Z�ж���ͬһ�����ʣ�����ת��Ϊ��ҺW�����ӷ���ʽΪ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ͭ����Ҫ�ɷ�ΪCu2S��������Fe2O3��SiO2�����ʣ��Ʊ�Cu2(OH)2CO3���乤���������£�
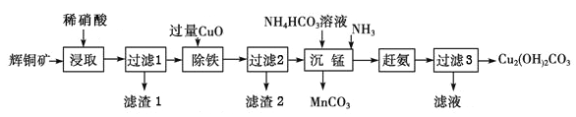
��1��������������У�����ʯ���飬��Ŀ����__________�������ܼӿ��ʯ�ۡ���������ʣ����¶Ȳ��˹��ߣ���ԭ����__________��
��2��Cu2S�����ᷴӦ���仹ԭ����ΪNO����֪1 mol Cu2S��ȫ��Ӧʱת��10 mol���ӡ�д���÷�Ӧ�����ӷ���ʽ��_____________________��
��3�����������м����������ͭ������Ӧ�����ӷ���ʽΪ___________________��
��4���ӹ���3�õ�����Һ�п���ȡһ�ַ��ϣ����Ļ�ѧʽΪ__________������1����Ҫ�ɷ���__________���ѧʽ����
��5�����ʵ��ȷ�Ϲ���2�õ�����Һ���Ƿ���Fe3+��___________________________��
��6��ȡwg��ͭ����������ת��������agCuO������2��bgCuO�����յ�cmolCu2(OH)2CO3������ͭԪ����ʧ����ԭ��ͭ��Cu2S����������Ϊ____________�����ô���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к͵ζ����ⶨij�ռ���Ʒ�Ĵ��ȣ������²��裺
��1�����ƴ���Һ����5.00g�����������ʣ����ʲ������ᷴӦ���Ĺ����ռ���Ʒ����1000mL��Һ�����ձ�����ͷ�ιܡ��������⣬����Ҫ�IJ��������� ______ ��
��2�����
��ʢװ0.1000molL-1�����ҺӦ��ʹ�� ______ ʽ�ζ��ܣ��ζ�ʱ������Ӧ�����ӷ���ʽΪ�� ______ ��
���й����ݼ�¼���£�
�ⶨ��� | ������Һ�����/mL | ���������Һ�����/mL | |
�ζ�ǰ | �ζ��� | ||
1 | 20.00 | 0.50 | 20.78 |
2 | 20.00 | 1.20 | 21.32 |
3 | 20.00 | 0.80 | 23.20 |
��3�����㣺�ռ���Ʒ�Ĵ����� ______ ��
��4����������ѡ����ƫ������ƫ����������Ӱ��������
��������ˮ��ϴ��ƿ�����ʹ�ⶨ��� ______ ��
�ڶ���ʱ���ζ�ǰ���ӣ��ζ����ӣ����ʹ�ⶨ��� ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X��һ�����ϣ��ɲ�����ϩ��ױ�Ϊ��Ҫԭ�ϣ�����ͼ·�ߺϳɣ�
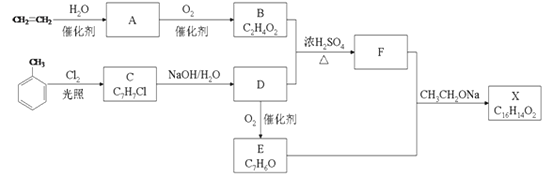
��1��д������ϩ��ȡA�Ļ�ѧ����ʽ��____��
��2����ϩ��ʹ��ˮ������KMnO4��Һ��ɫ��������ɫԭ����ͬ��_____��ԭ����______��
��3������ϩΪԭ�ϣ��ܷ��Ƶ���Ȳ��_____�����ܣ���д����صĻ�ѧ����ʽ_______��
��4����д��C�ĺ��б�����ͬ���칹��Ľṹ��ʽ��______��
��5��д���ױ���Ũ�����Ũ����Ļ���ᷴӦ�Ļ�ѧ����ʽ��_____��
��6��д��C��D�Ļ�ѧ����ʽ��_______��
��7��C�ܷ�����ȥ��Ӧ��______��ԭ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ѧ�ҿ�����һ�ֵͳɱ����������������״ʯīϩ������ԭ����:Na2O+2CO![]() Na2CO3+C(ʯ��ϩ)��Ȼ���ȥNa2CO3�������Ƶ÷���״ʯīϩ������˵������ȷ����
Na2CO3+C(ʯ��ϩ)��Ȼ���ȥNa2CO3�������Ƶ÷���״ʯīϩ������˵������ȷ����
A. ������ʯīϩ�ķ�Ӧ����������ԭ��Ӧ
B. ʯīϩ����ʯ��Ϊͬ��������
C. Na2O���ڼ��������CO�������������Na2CO3������
D. ��Ȼ����̼Ԫ��������̬�ͻ���̬���ִ�����ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ɵ��������ܸ����Ŀ������ĸо�����Ҫ���㾫���ƾ���ˮ���ɵ���ˮ���ܰ�����ʿ���������㾫���溬���������ʣ���ҵ����AΪ��Ҫԭ�����ϳ�������������ϳ�·������ͼ��ʾ������A��ʯ���ѽ�������Ҫ�ɷ֣�A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����֪2CH3CHO+O2![]() 2CH3COOH����ش��������⣺
2CH3COOH����ش��������⣺
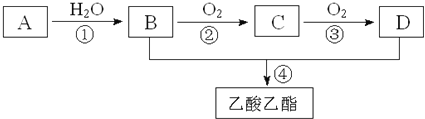
��1��д��A�ĵ���ʽ__________��
��2��B��D�����ں��еĹ����ŷֱ���__________��__________�������ƣ���
��3��д�����з�Ӧ�ķ�Ӧ���ͣ���______________����______________��
��4��д�����з�Ӧ�Ļ�ѧ����ʽ��
��__________________________________________________��
��__________________________________________________��
��__________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com