
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答:
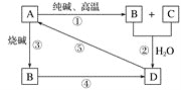
(1)A是______,B是_____,D是_____。
(2)写化学方程式:
①_________;
⑤_________。
(3)写离子方程式:
②__________;
③________;
④________。
【答案】SiO2 Na2SiO3 H2SiO3 Na2CO3+SiO2![]() Na2SiO3+CO2↑ H2SiO3
Na2SiO3+CO2↑ H2SiO3![]() H2O+SiO2 CO2+H2O+SiO32-=CO32-+H2SiO3↓ SiO2+2OH-=SiO32-+H2O SiO32-+2H+=H2SiO3↓
H2O+SiO2 CO2+H2O+SiO32-=CO32-+H2SiO3↓ SiO2+2OH-=SiO32-+H2O SiO32-+2H+=H2SiO3↓
【解析】
由“A是一种不溶于水的固体非金属氧化物”可推知A为SiO2,再结合SiO2的相关性质:SiO2跟Na2CO3在高温下反应生成Na2SiO3和CO2,二者在水中会反应生成H2SiO3沉淀,则D为H2SiO3,H2SiO3受热分解生成SiO2和H2O,说明A为SiO2是正确的,③为SiO2和NaOH的反应,可知B为Na2SiO3,则C为CO2,Na2SiO3可与酸反应生成硅酸,据此答题。
由以上分析可知A为SiO2,B为Na2SiO3,C为CO2,D为H2SiO3。
(1)由以上分析可知A为SiO2,B为Na2SiO3,D为H2SiO3,故答案为:SiO2;Na2SiO3; H2SiO3。
(2)①SiO2和碳酸钠在高温下反应生成硅酸钠和二氧化碳,反应的方程式为SiO2+Na2CO3![]() Na2SiO3+CO2↑,故答案为:SiO2+Na2CO3
Na2SiO3+CO2↑,故答案为:SiO2+Na2CO3![]() Na2SiO3+CO2↑。
Na2SiO3+CO2↑。
⑤H2SiO3受热分解生成SiO2和H2O,反应方程式为:H2SiO3![]() H2O+SiO2,故答案为:H2SiO3
H2O+SiO2,故答案为:H2SiO3![]() H2O+SiO2。
H2O+SiO2。
(3)②硅酸酸性比碳酸弱,硅酸钠和二氧化碳、水反应可生成硅酸,反应的方程式为Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3,离子方程式为:CO2+H2O+SiO32-=CO32-+H2SiO3↓,故答案为:CO2+H2O+SiO32-=CO32-+H2SiO3↓。
③二氧化硅和氢氧化钠反应生成硅酸钠和水,反应的化学方程式为SiO2+2NaOH═Na2SiO3+H2O,离子方程式为SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O。
④Na2SiO3可与盐酸反应生成硅酸,方程式为Na2SiO3+2HCl═2NaCl+H2SiO3↓,离子方程式为:SiO32-+2H+=H2SiO3↓,故答案为:SiO32-+2H+=H2SiO3↓。


科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)时一种重要的化学试剂,通常条件下为棕色易水解的固体。某小组在实验室制备氮化钙并测定其纯度,设计如下实验
Ⅰ.氮化钙的制备。
(1)加热条件下,钙和氮气制备氮化钙的反应方程式为______。
(2)钙和氮气制备氮化钙的装置如下(夹持装置略去):

上述装置合理的连接顺序为______(按气流方向,用接口字母表示,装置不重复使用)。
(3)按连接好的装置进行实验。
①实验步骤如下:检查装置气密性、加入药品:______ (请按正确顺序填入下列步骤的字母标号)。
a.点燃装置C处酒精灯,反应一段时间
b.打开分液漏斗活塞
c.点燃装置A处酒精灯
d.熄灭装置A处酒精灯
e.熄灭装置C处酒精灯
f.关闭分液漏斗活塞
②装置B的作用为______。
③装置C的硬质玻璃管中的现象为______
(4)设计实验证明Ca3N2中混有钙单质:______
Ⅱ.测定氮化钙纯度
ⅰ称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1.00mol/L的盐酸中,充分反应后,将所得溶液稀释到200.00mL;
ii.取20.00mL稀释后的溶液,用0.2mol/LNaOH标准溶液滴定过量的盐酸,到终点时消耗标准溶液25.00mL。
(5)所取固体中氮化钙的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列方案可以提高尾气处理效率的是( )
N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③增大装置的压强 ④装置中放入碱石灰
A. ①③④ B. ①②③ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,氧化剂与还原剂的物质的量之比是_____,当有2molHNO3参加反应时,被氧化的物质是____g,电子转移数目约为_____个。
(2)在反应K2S+4H2SO4(浓)![]() K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
(3)某同学写出以下三个化学方程式:(未配平)
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为不可能实现的是______。
(4)今有下列三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
氧化性最强的物质的是____(填字母,下同),若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是____。
A.Cl2 B.KMnO4 C.FeCl3 D.I2
(5)30mL浓度为0.05mol·L-1的Na2SO3溶液恰好与25mL浓度为0.02mol·L-1的K2R2O7溶液反应,则元素R在还原产物中的化合价是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
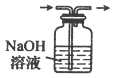
【题目】下列说法正确的是( )
A.碳素钢、青铜、铁红都属于合金
B.用澄清石灰水可鉴别Na2CO3和NaHCO3两种溶液
C.氯水久置后漂白性减弱、酸性增强
D.可通过图装置除去Cl2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)三种金属与同浓度盐酸反应,反应最慢的是___(填选项)。
a.钠 b.铝 c.铁
(2)金属钠与水发生反应的离子方程式为___;(填选项)
a.2Na +2H2O=2NaOH+H2↑
b.2Na+2H2O=2Na++2OH-+H2↑
c.2Na +2H2O=2Na++2OH-+O2↑
(3)可观察到的实验现象正确的是__(填选项)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(4)填写a、b、c化学式并书写①的化学方程式(a、b、c均为含Al化合物);
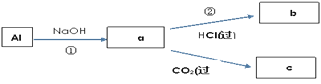
a:___,b:___,c:___;
①____________;
(5)Fe跟Cl2在一定条件下反应,所得产物为___。
(6)将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,产生__色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所选择的装置或操作正确的是( )
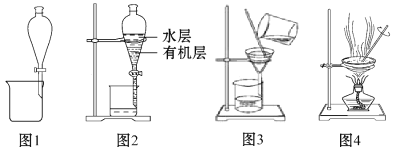
A.用图1所示的装置可以实现用酒精提取溴水中的Br2
B.用图2所示的装置分层时,两层液体先后从下口出
C.粗盐提纯,除去沉淀和泥沙等杂质时,选图3所示的装置
D.NaCl溶液蒸发结晶时,选图4所示的装置,至蒸发皿中晶体全部析出时再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 molL-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____________。
(2)在t2℃下,将a molL-1CH3COOH溶液与b molL-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=____________(用a、b表示)。
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq) △H=a kJmol-1 K=c;
Ag(NH3)2+(aq) △H=a kJmol-1 K=c;
②2Ag+(aq)+2OH-(aq)![]() Ag2O(s)+H2O(l) △H=b kJmol-1 K=d
Ag2O(s)+H2O(l) △H=b kJmol-1 K=d
(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:_____________;计算25℃下,该反应的平衡常数(用c、d表示)K=____________________。
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol/L) | 0.5 | 0.01 | a |
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的a____________1.03(填“<”、“>”或“=”)。
(5)除去杂质Cr3+离,可加入MgO调节溶液pH,理论上应调节pH的范围是_______________。
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl26H2O)的操作是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质。据此填空。
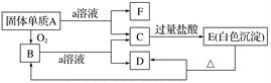
(1)写出各物质的化学式:
A.________、B________、C________、
D.________、E________、F________。
(2)B与a溶液反应的离子方程式是_________。
(3)A与a溶液反应的离子方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com