
【题目】I.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 molL-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____________。
(2)在t2℃下,将a molL-1CH3COOH溶液与b molL-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=____________(用a、b表示)。
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq) △H=a kJmol-1 K=c;
Ag(NH3)2+(aq) △H=a kJmol-1 K=c;
②2Ag+(aq)+2OH-(aq)![]() Ag2O(s)+H2O(l) △H=b kJmol-1 K=d
Ag2O(s)+H2O(l) △H=b kJmol-1 K=d
(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:_____________;计算25℃下,该反应的平衡常数(用c、d表示)K=____________________。
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol/L) | 0.5 | 0.01 | a |
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的a____________1.03(填“<”、“>”或“=”)。
(5)除去杂质Cr3+离,可加入MgO调节溶液pH,理论上应调节pH的范围是_______________。
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl26H2O)的操作是___________________。
【答案】1000:1 10-6b/(a-b) Ag2O(s)+H2O(l)+4NH3(aq)![]() 2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJmol-1
2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJmol-1 ![]() > 5<pH≤9 滤液中加盐酸(或在HCl气流中),加热浓缩,冷却结晶,过滤
> 5<pH≤9 滤液中加盐酸(或在HCl气流中),加热浓缩,冷却结晶,过滤
【解析】
(1)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 molL-1,c(Na+)=2c(SO42-)=1×10-3 molL-1,取该溶液1mL加水稀释至10mL,则根据稀释前后溶质的物质的量不变可知稀释后溶液中c(Na+)=1×10-4 molL-1,由于溶液显中性,所以c(OH-)=1×10-7 molL-1,则稀释后溶液中c(Na+):c(OH-)=1×10-4 molL-1:1×10-7 molL-1=1000:1;
(2)在t2℃下,将a molL-1CH3COOH溶液与b molL-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数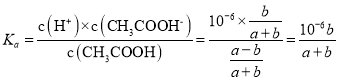 ;
;
(3)根据盖斯定律可知①×2-②,整理可得Ag2O(s)+H2O(l)+4NH3(aq)![]() 2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJmol-1;在25℃下,该反应的平衡常数(用c、d表示)
2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJmol-1;在25℃下,该反应的平衡常数(用c、d表示)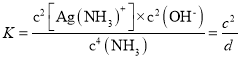 ;
;
(4)在任何溶液中阳离子带有的正电荷总数与阴离子带有的负电荷总数相等。2c(Mg2+)+3c(Cr3+)+c(H+)=c(Cl-)+c(OH-);2×0.5mol/L+3×0.01mol/L+c(H+)=c(Cl-)+c(OH-),由于该盐溶液都是强酸弱碱盐,水解时溶液显酸性,c(H+)>c(OH-),所以c(Cl-)>2×0.5mol/L+3×0.01mol/L=1.03mol/L;
(5)根据Ksp[Cr(OH)3]=10-32,可知使Cr3+形成沉淀完全的最小的c3(OH-)=10-32÷10-5=10-27,所以c(OH-)=10-9mol/L;则pH=9,由于溶液中c(Mg2+)=0.5mol/L,则根据Ksp[Mg(OH)2]=5×10-11可知使Mg2+不形成沉淀c2(OH-)=5×10-11÷0.5=1×10-10,所以c(OH-)=10-5mol/L;则pH=5。故除去杂质Cr3+离子,可加入MgO调节溶液pH,理论上应调节pH的范围是5<pH≤9;
(6)溶液经除杂、过滤后得到的就是氯化镁溶液,由于氯化镁水解,所以由滤液制取氯化镁晶体(MgCl26H2O)的操作是滤液中加盐酸酸化(或在HCl气流中),然后加热浓缩,冷却结晶,过滤,就得到氯化镁晶体。


科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)将12.5g CuSO4·5H2O溶于水中形成1L溶液,溶质的物质的量浓度为_________mol·L-1
(2)氢原子的物质的量相等四种气体HCl、H2、NH3、CH4,在同温同压下,此四种气体体积之比V(HCl):V(H2):V(NH3):V(CH4)=______________。
(3)配制100mL 1.00 mol·L-1H2SO4溶液,需要用量筒量取浓硫酸(密度为1.84g·cm-3,溶质质量分数为98%)的体积为_____________mL。
(4)反应2K2S+ K2SO3+3H2SO4=3S↓+3 K2SO4+3H2O中,氧化剂与还原剂的物质的量之比为______,若反应生成0.6molS,则反应中转移的电子为____________mol。
(5)现有下列5种物质:①CO2 ②Mg ③盐酸 ④NaCl ⑤Na2CO3。上述物质属于电解质的有_____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答:
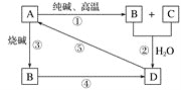
(1)A是______,B是_____,D是_____。
(2)写化学方程式:
①_________;
⑤_________。
(3)写离子方程式:
②__________;
③________;
④________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验,将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 浓硫酸 | 用砂纸打磨过的铁片 | 产生大量气泡 |
B | AgNO3溶液 | 浓氨水 | 产生白色沉淀且不消失 |
C | NH4Cl浓溶液 | Fe、C混合物 | 溶液中有气泡产生 |
D | H2O2溶液 | FeCl3溶液 | 溶液逐渐褪色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=-1234.8kJ·mol-1
结论:C2H5OH的燃烧热 △H=-1234.8 kJ·mol-1
B. 稀溶液中有H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1
结论:将稀醋酸与NaOH的稀溶液混合后,若有1 mol H2O生成,则放出的能量等于57.3kJ
C. C(s,石墨)=C(s,金刚石) △H=+1.5kJ·mol-1
结论:相同条件下金刚石比石墨稳定
D. Sn(s,灰)![]() Sn(s,白) △H=+2.1kJ·mol-1(灰锡为粉末状)
Sn(s,白) △H=+2.1kJ·mol-1(灰锡为粉末状)
结论:锡制品在寒冷的冬天更容易损坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)

根据以上信息填空:
(1)写出下列物质的化学式:A______ G__________ ;
(2)纯净的气体甲在气体乙中燃烧的现象:______________________________________;
(3)写出下列反应的离子方程式:反应①_________________________;反应④____________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环中不存在碳碳单键和碳碳双键交替的结构,可以作为证据的事实是( )
①苯是无色易挥发的液体;
②苯不能使酸性高锰酸钾溶液褪色;
③![]() 和
和 是同一种物质。
是同一种物质。
A. ①②③ B. ①和② C. ①和③ D. ②和③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com