
【题目】用如图所示装置进行下列实验,将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 浓硫酸 | 用砂纸打磨过的铁片 | 产生大量气泡 |
B | AgNO3溶液 | 浓氨水 | 产生白色沉淀且不消失 |
C | NH4Cl浓溶液 | Fe、C混合物 | 溶液中有气泡产生 |
D | H2O2溶液 | FeCl3溶液 | 溶液逐渐褪色 |
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】某工厂排放的废水中含有氰化物,可在碱性条件下对氰化物进行净化处理:2CN-+8OH- +5C12=2CO2+N2+10Cl-+4H2O。下列分析中错误的是( )
A.当反应消耗0.2 mol CN-时,反应中转移电子的物质的量是1 mol
B.还原性:CN->Cl-
C.CN-的电子式为![]()
D.该反应中氧化剂和还原剂的物质的量之比是2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)三种金属与同浓度盐酸反应,反应最慢的是___(填选项)。
a.钠 b.铝 c.铁
(2)金属钠与水发生反应的离子方程式为___;(填选项)
a.2Na +2H2O=2NaOH+H2↑
b.2Na+2H2O=2Na++2OH-+H2↑
c.2Na +2H2O=2Na++2OH-+O2↑
(3)可观察到的实验现象正确的是__(填选项)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(4)填写a、b、c化学式并书写①的化学方程式(a、b、c均为含Al化合物);
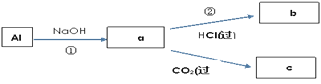
a:___,b:___,c:___;
①____________;
(5)Fe跟Cl2在一定条件下反应,所得产物为___。
(6)将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,产生__色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填写下列内容:
(1)2.5molH2SO4的质量是___;
(2)H3PO4的摩尔质量为___;
(3)等质量的氧气和臭氧,他们原子的个数之比为___;
(4)6.02×1023个N2所含___mol质子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 molL-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____________。
(2)在t2℃下,将a molL-1CH3COOH溶液与b molL-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=____________(用a、b表示)。
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq) △H=a kJmol-1 K=c;
Ag(NH3)2+(aq) △H=a kJmol-1 K=c;
②2Ag+(aq)+2OH-(aq)![]() Ag2O(s)+H2O(l) △H=b kJmol-1 K=d
Ag2O(s)+H2O(l) △H=b kJmol-1 K=d
(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:_____________;计算25℃下,该反应的平衡常数(用c、d表示)K=____________________。
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol/L) | 0.5 | 0.01 | a |
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的a____________1.03(填“<”、“>”或“=”)。
(5)除去杂质Cr3+离,可加入MgO调节溶液pH,理论上应调节pH的范围是_______________。
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl26H2O)的操作是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠-过氧化氢加合物(xNa2SO4 ·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.77g样品,配制成100.00mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的氯化钡溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.0025mol。
③准确量取25.00mL溶液A,加入适量的稀硫酸酸化后,用0.02mol·L-1 KMnO4溶液滴定至终点(KMnO4只与加合物中的H2O2发生反应),消耗KMnO4溶液25.00mL。回答下列问题:
(1)在步骤①中,所需玻璃仪器除了烧杯外还需要________________;
(2)在步骤①中,下列操作会使所配溶液浓度偏低的是_______(填字母);
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视仪器上的刻度线
C.定容后震荡摇匀静置,发现液面低于刻度线,于是又加入少量水至刻度线
D.配制前容量瓶中有少量水
(3)③中的KMnO4溶液置于_______(“酸式”或“碱式”)滴定管中,滴定终点的现象是____________________,写出滴定中发生的离子反应方程式_______________;
(4)通过计算确定样品的组成为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是___。
(2)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是___;过一会儿,溶液颜色逐渐褪去,起作用的成分是___;
(3)鉴别Na2CO3和NaHCO3溶液可选用___。(填序号)
①NaOH ②Ca(OH)2 ③BaCl2 ④K2SO4 ⑤Ca(NO3)2
(4)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。
①其中被还原的元素是___。
②当反应有3.612×1024个电子转移时被硝酸钾氧化得到的氧化产物在标准状况下的体积___。
(5)1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是___,R的相对原子质量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图装置进行CO和CO2混合气体的分离和干燥。其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否)。
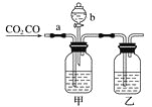
(1)从氢氧化钠、稀硫酸、浓硫酸几种物质中选择合适的物质填入下列空格中,便可达到实验目的,甲瓶内盛________溶液,乙瓶内盛________溶液,分液漏斗内盛________溶液。
(2)实验时先分离出CO,方法是先关闭___(填a或b,下同),打开___,写出此时发生反应的离子方程式:____。
(3)分离完CO后,再收集CO2,方法是先关闭____,再打开____,写出此时产生CO2反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图装置进行CO和CO2混合气体的分离和干燥。其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否)。
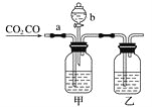
(1)从氢氧化钠、稀硫酸、浓硫酸几种物质中选择合适的物质填入下列空格中,便可达到实验目的,甲瓶内盛________溶液,乙瓶内盛________溶液,分液漏斗内盛________溶液。
(2)实验时先分离出CO,方法是先关闭___(填a或b,下同),打开___,写出此时发生反应的离子方程式:____。
(3)分离完CO后,再收集CO2,方法是先关闭____,再打开____,写出此时产生CO2反应的离子方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com