
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)三种金属与同浓度盐酸反应,反应最慢的是___(填选项)。
a.钠 b.铝 c.铁
(2)金属钠与水发生反应的离子方程式为___;(填选项)
a.2Na +2H2O=2NaOH+H2↑
b.2Na+2H2O=2Na++2OH-+H2↑
c.2Na +2H2O=2Na++2OH-+O2↑
(3)可观察到的实验现象正确的是__(填选项)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(4)填写a、b、c化学式并书写①的化学方程式(a、b、c均为含Al化合物);
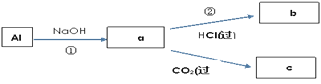
a:___,b:___,c:___;
①____________;
(5)Fe跟Cl2在一定条件下反应,所得产物为___。
(6)将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,产生__色沉淀。
【答案】c b bc NaAlO2 AlCl3 Al(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ FeCl3 红 红褐
【解析】
(1)金属越活泼,与盐酸反应与剧烈,根据钠、铝、铁的活泼性分析判断;
(2)钠与水反应生成NaOH和氢气,且钠的密度比水的密度小,据此分析解答(2)和(3);
(4)由转化可知,①中Al与NaOH反应生成NaAlO2,②中NaAlO2与过量盐酸反应生成AlCl3,NaAlO2与过量二氧化碳反应生成Al(OH)3沉淀,据此分析解答;
(5)Fe跟Cl2反应生成氯化铁,溶液含铁离子,遇KSCN变为血红色,加NaOH生成红褐色沉淀,据此分析解答(5)和(6)。
(1)金属越活泼,与盐酸反应与剧烈,钠、铝、铁中钠最活泼,铁活泼性最差,与同浓度盐酸反应,反应最慢的是铁,故答案为:c;
(2)钠与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故答案为:b;
(3)钠与水反应生成氢氧化钠和氢气,可观察到钠浮在水面上,熔成小球、小球四处游动,故答案为:bc;
(4)由上述分析可知,a、b、c分别为NaAlO2、AlCl3、Al(OH)3,反应①的离子方程式分别为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:NaAlO2;AlCl3;Al(OH)3;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(5)Fe跟Cl2在一定条件下反应生成氯化铁,化学式为FeCl3,故答案为:FeCl3;
(6)将FeCl3溶于水配成溶液,分装在两支试管中。a.若向其中一支试管中滴加KSCN溶液,溶液变成红色;b.向另一支试管中滴加NaOH溶液,反应生成红褐色的氢氧化铁沉淀,反应的离子方程式是Fe3++3OH-═Fe(OH)3↓,故答案为:红;红褐。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)将pH=l的盐酸平均分成2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为____。
(2)在100℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为___
(3)在250C时,有pH为a的盐酸和pH为b的NaOH溶液,取Va L该盐酸,同该NaOH溶液中和,需Vb LNaOH溶液。填空:
①若a + b = 14,则Va∶Vb = __(填数字)。
②若a + b = 13,则Va∶Vb = ___(填数字)。
③若a + b >14,则Va∶Vb = ___(填表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,一定量的二氧化硫与1.100mol氧气在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A. 三氧化硫生成的速率与二氧化硫消耗的速率相等时反应达到平衡
B. 降低温度,正反应速率减小,逆反应速率增大
C. 平衡混合气体通入过量氯化钡溶液中,得到沉淀的质量为161.980g
D. 达到平衡时,二氧化硫的转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
B.1molCl2与足量Fe反应,转移的电子数为3NA
C.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
D.在H2O2+Cl2=2HCl+O2反应中,每生成32g 氧气,转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答:
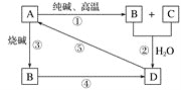
(1)A是______,B是_____,D是_____。
(2)写化学方程式:
①_________;
⑤_________。
(3)写离子方程式:
②__________;
③________;
④________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是![]() ,含
,含![]() 、
、![]() 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
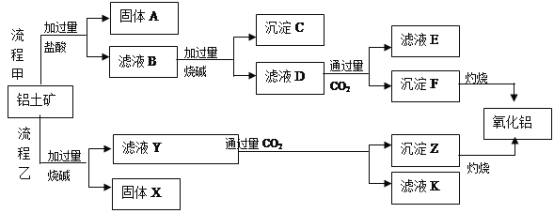
请回答下列问题:
(1)流程乙加入烧碱后的离子方程式为_________________________________________.
(2)固体A的应用_________________________________________.(两点)
(3)滤液D与少量CO2反应的离子方程式为__________________________________,
向该滤液K中加入足量石灰水的离子方程式是________
(4)流程乙制氧化铝的优点是所用的试剂较经济,缺点是__________________________
(5)已知298K时,![]() 的溶度积常数
的溶度积常数![]() =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的pH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的pH最小为_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验,将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 浓硫酸 | 用砂纸打磨过的铁片 | 产生大量气泡 |
B | AgNO3溶液 | 浓氨水 | 产生白色沉淀且不消失 |
C | NH4Cl浓溶液 | Fe、C混合物 | 溶液中有气泡产生 |
D | H2O2溶液 | FeCl3溶液 | 溶液逐渐褪色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,如合成的金刚烷胺就是一种抗病毒药剂,对帕金森症、老年痴呆有良好的疗效.由环戊二烯合成金刚烷的路线如下:
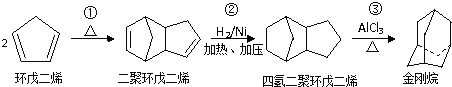
请回答下列问题:
(1)金刚烷的分子式为 ______ .
(2)反应①的反应类型是 ______ .
(3)金刚烷与四氢二聚环戊二烯的关系是 ______ .(填字母)
a 互为同系物 b 互为同分异构体 c 均为烷烃 d 均为环烃
(4)下面是以环戊烷为原料制备环戊二烯的合成路线:
![]()
其中,反应②的反应试剂和反应条件是 ______ ;X的名称是 ______ ;反应④的化学方程式是 ______ ;
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基(-CH3、-CH2R、-CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基],则A的结构有 ______ 种(不考虑立体异构),其中核磁共振氢普为5组峰,且面积比为4:1:2:2:3的结构简式是 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com