
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)

根据以上信息填空:
(1)写出下列物质的化学式:A______ G__________ ;
(2)纯净的气体甲在气体乙中燃烧的现象:______________________________________;
(3)写出下列反应的离子方程式:反应①_________________________;反应④____________________________;
【答案】 Na Fe(OH)3 产生苍白色火焰,放出大量的热,出现白雾 2Na+2H2O=2Na++2OH-+H2↑ 2Fe2++Cl2=2Fe3++2Cl-
【解析】金属A焰色反应为黄色,故A为金属Na;由反应①Na+H2O→气体甲+C,则甲为H2,C为NaOH;乙是黄绿色气体,则乙为Cl2;反应②:气体甲+气体乙→气体丙,即H2+Cl2→HCl,则丙为HCl;红褐色沉淀G为Fe(OH)3;反应⑤:物质C+物质F→沉淀G,即NaOH+F→Fe(OH)3,可推断F中含有Fe3+;反应④:物质E+Cl2→物质F,则E中含有Fe2+;反应③:丙的水溶液D+金属B→物质E,可推断金属B为Fe,则E为FeCl2,F为FeCl3。
(1)根据上述分析可知A为Na;G为Fe(OH)3 ;
(2)气体甲为H2,气体乙为Cl2,氢气在氯气中燃烧的现象为:产生苍白色火焰,放出大量的热,出现白雾;
(3)反应①为钠和水的反应,离子方程式为:2Na+2H2O=2Na++2OH-+H2↑ ;反应④为FeCl2与的反应,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某固体A在一定条件下加热分解,产物全是气体。A的分解反应为:2A=B+2C+2D,现测得分解产生的混合气体的密度是相同条件下氢气的d倍,则A的相对分子质量为
A. 2d B. 2.5d C. 5d D. 0.8d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为 ![]() ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)元素A、B、C、D分别是:A , B , C , D .
(2)D元素在周期表中属第周期族.
(3)用电子式表示A的气态氢化物的形成过程: .
(4)A和B的单质充分反应生成化合物的电子式是 .
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明; .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于1.5mol 氢气的叙述中,正确的是( )
A. 质量是 4g
B. 体积是 33.6L
C. 电子数是 3
D. 分子数约为1.5×6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产等资源,如图表示海水综合利用的部分过程.下列说法不正确的是( ) 
A.工业上通过电解熔融状态MgCl2制取金属镁
B.用澄清石灰水可鉴别NaHCO3和Na2CO3
C.在第②、④步骤中,溴元素均被氧化
D.制取NaHCO3的反应中,利用了其溶解度在相同条件下小于NaCl的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物J是在医疗上有重要的应用,分子结构中含有3个六元环.其中一种合成路线如图: 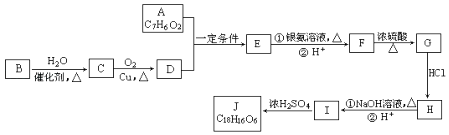
已知:
①A既能发生银镜反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4个吸收峰,且峰面积之比为1:2:2:1.
②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平.
③R1﹣CHO+R2﹣CH2﹣CHO ![]()
![]()
请回答下列问题:
(1)E的结构简式是 , G中含氧官能团的名称 .
(2)写出有机反应类型H→I , F→G .
(3)写出I生成J的化学方程式 .
(4)A的含苯环同分异构体有种,写出其中符合以下要求的同分异构体的结构简式 . ①能发生银镜反应 ②能发生水解反应 ③含有苯环
(5)写出用B合成 ![]() 的路线图(提示:路线图的书写方法RCH=CH2
的路线图(提示:路线图的书写方法RCH=CH2![]()
![]()
![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4﹣、C2O42﹣三者中所占物质的量分数〔分布系数)随pH变化的关系如图所示.下列表述不正确的是( ) 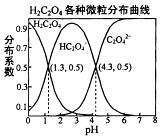
A.HC2O4﹣H++C2O42﹣ , K=1×10﹣4.3
B.将等物质的量的NaHC2O4、NAa2C2O4溶于水中,所得溶液PH恰好为4.3
C.常温下HF的KB=1×10﹣﹣3.45 , 将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F﹣=HF+HC2O4﹣
D.在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:_____________________ 。
(2)铝还用于冶炼熔点较高的金属如钒、铬、锰等,请配平下列用铝冶炼金属钒的化学反应方程式:_____ V2O5 + Al ![]() Al2O3 + V。该反应中氧化剂是__________________ ,要得到1mol金属钒,需要纯铝的质量__________g。
Al2O3 + V。该反应中氧化剂是__________________ ,要得到1mol金属钒,需要纯铝的质量__________g。
(3)铝与NaOH溶液反应的离子方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com