
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为 ![]() ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)元素A、B、C、D分别是:A , B , C , D .
(2)D元素在周期表中属第周期族.
(3)用电子式表示A的气态氢化物的形成过程: .
(4)A和B的单质充分反应生成化合物的电子式是 .
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明; .
【答案】
(1)碳;氧;镁;铝
(2)三;ⅢA
(3)![]() +4H→
+4H→ 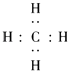
(4)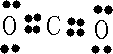
(5)离子化合物;检验方法为:验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物
【解析】答案:(1)B原子L层的电子总数是K层的3倍,则B的原子原子核外各层电子数分别为2、6,应为O元素,根据A的电子式可知A的最外层有4个电子,应为周期表第ⅣA族元素,又原子序数小于O,应为C元素,0.1mol C单质能从酸中置换出2.24L氢气(标准状况),则C的最外层有2个电子,离子的与氖原子的电子层结构相同,则C为Mg元素,D离子的半径比C离子的小,D离子与B离子的电子层结构相同,D应为Al元素,故答案为:碳,氧,镁,铝;(2)D为Al元素,原子序数为13,原子核外有3个电子层,最外层电子数为3,位于周期表第三周期ⅢA族,
故答案为:三,ⅢA;(3)A的气态氢化物为CH4 , 用电子式表示形成过程为 ![]() +4H→
+4H→  ,故答案为:
,故答案为: ![]() +4H→
+4H→ 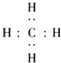 ;(4)A和B的单质充分反应生成化合物为CO2 , 电子式为
;(4)A和B的单质充分反应生成化合物为CO2 , 电子式为 ![]() ,故答案为:
,故答案为: ![]() ;(5)B与C形成的化合物为MgO,为离子化合物,可用熔融状态下是否导电验证,离子化合物在熔融状态下导电,而共价化合物不导电,
;(5)B与C形成的化合物为MgO,为离子化合物,可用熔融状态下是否导电验证,离子化合物在熔融状态下导电,而共价化合物不导电,
故答案为:离子化合物;检验方法为:验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物.
B原子L层的电子总数是K层的3倍,则B的原子原子核外各层电子数分别为2、6,应为O元素,根据A的电子式可知A的最外层有4个电子,应为周期表第ⅣA族元素,又原子序数小于O,应为C元素,0.1mol C单质能从酸中置换出2.24L氢气(标准状况),则C的最外层有2个电子,离子的与氖原子的电子层结构相同,则C为Mg元素,D离子的半径比C离子的小,D离子与B离子的电子层结构相同,D应为Al元素,根据元素对应的原子结构以及形成化合物的性质解答该题.


科目:高中化学 来源: 题型:
【题目】在标准状况下,等质量的CH4 和CO2比较,下列说法中正确的是
A. 密度比4:11 B. 分子数之比为4:11
C. 体积比4:11 D. 物质的量之比为4:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要的催化剂和合金材料.请回答:
(1)基态V原子的价层电子排布式为;其中能量最高的电子所占用能级的原子轨道有个伸展方向.
(2)VO2+与  可形成配合物.
可形成配合物.  中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
(3)镍形成的Ni(NH3)62+、Ni(CN)42﹣中,NH3分子中N原子的价层电子对数目为 . 写出一种与CN﹣互为等电子体的分子的化学式: .
(4)La﹣Ni合金是重要的储氢材料,储氢后的晶胞如图所示.①合金中,1个La原子周围距离最近切相等的La原子数目为 . ②含有1molNi原子的合金中储存H2的物质的量为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当光束分别通过下列分散系时,能观察到丁达尔效应的是
A. NaOH溶液 B. Fe(OH)3胶体 C. C2H5OH溶液 D. CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.08mol气体;
第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
(已知, ![]() +OH-
+OH-![]() H2O+NH3↑)
H2O+NH3↑)
根据上述实验,回答以下问题。
(1)由第一份进行的实验推断该混合物是否一定含有Cl-?____________(答是或否)。
(2)由第二份进行的实验得知混合物中应含有____________(填离子符号),其物质的量浓度为____________。
(3)由第三份进行的实验可知12.54g沉淀的成分为____________。
(4)综合上述实验,你认为以下结论正确的是(______)
A.该混合液中一定含有K+、![]() 、
、![]() 、
、![]() ,可能含Cl-,且n(K+)≥0.04mol
,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含K+、Cl-
,可能含K+、Cl-
C.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
D.该混合液中一定含有![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应。又知E溶液是无色的,F溶液是浅绿色的。

请回答:
(1)试写出下列物质的化学式:A____________________,B_____________________。
(2)反应①的化学方程式:___________,E溶液中溶质的电离方程式是____________。
(3)反应③的离子方程式:________________________________。
(4)工业上经常利用B气体制取漂白粉,该反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)

根据以上信息填空:
(1)写出下列物质的化学式:A______ G__________ ;
(2)纯净的气体甲在气体乙中燃烧的现象:______________________________________;
(3)写出下列反应的离子方程式:反应①_________________________;反应④____________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )

A. 曲线a表示Na+的物质的量的变化
B. 曲线c表示Ba2+的物质的量的变化
C. 加入50 mL Ba(OH)2溶液时反应的离子方程式为Ba2++2OH-+2H++ ![]() BaSO4↓+2H2O
BaSO4↓+2H2O
D. 加入Ba(OH)2溶液体积大于50 mL后,反应的离子方程式为OH-+H+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com