
【题目】钒和镍及其化合物是重要的催化剂和合金材料.请回答:
(1)基态V原子的价层电子排布式为;其中能量最高的电子所占用能级的原子轨道有个伸展方向.
(2)VO2+与  可形成配合物.
可形成配合物.  中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
(3)镍形成的Ni(NH3)62+、Ni(CN)42﹣中,NH3分子中N原子的价层电子对数目为 . 写出一种与CN﹣互为等电子体的分子的化学式: .
(4)La﹣Ni合金是重要的储氢材料,储氢后的晶胞如图所示.①合金中,1个La原子周围距离最近切相等的La原子数目为 . ②含有1molNi原子的合金中储存H2的物质的量为 . 
【答案】
(1)3d34s2;5
(2)O>C>H;sp3和sp2
(3)4;CO或者N2
(4)6;0.6mol
【解析】解:(1)V原子为23号元素,则价层电子排布式为:3d34s2;能量最高的为3d轨道,有5个伸展方向;故答案为:3d34s2;5;(2)  中,三种非金属原子分别为H、C、O,又同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族从上到下,元素的第一电离能逐渐减小,所以H、C、O三种非金属原子的第一电离能由大到小的顺序为O>C>H;又由
中,三种非金属原子分别为H、C、O,又同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族从上到下,元素的第一电离能逐渐减小,所以H、C、O三种非金属原子的第一电离能由大到小的顺序为O>C>H;又由  可以看出C原子分别形成单键和双键,则C原子的杂化轨道类型为sp3和sp2;故答案为:O>C>H;sp3和sp2;(3)NH3分子中N原子共用电子对数为3对,还有1对孤电子对,所以NH3分子中N原子的价层电子排布对数目位4对;CN﹣中含有2个原子,且其价电子数是10,与CN﹣互为等电子体的一种分子为CO、N2等,故答案为:4;CO或者N2;(4)①由晶胞可以看出1个La原子周围距离最近的La原子在顶点上,所以距离最近且相等的La原子数目为6,故答案为:6;②根据晶胞可以看出La原子个数为8×
可以看出C原子分别形成单键和双键,则C原子的杂化轨道类型为sp3和sp2;故答案为:O>C>H;sp3和sp2;(3)NH3分子中N原子共用电子对数为3对,还有1对孤电子对,所以NH3分子中N原子的价层电子排布对数目位4对;CN﹣中含有2个原子,且其价电子数是10,与CN﹣互为等电子体的一种分子为CO、N2等,故答案为:4;CO或者N2;(4)①由晶胞可以看出1个La原子周围距离最近的La原子在顶点上,所以距离最近且相等的La原子数目为6,故答案为:6;②根据晶胞可以看出La原子个数为8× ![]() =1,Ni原子个数为8×
=1,Ni原子个数为8× ![]() +1=5,所以合金化学式为LaNi5 , 并且一个晶胞储存2×
+1=5,所以合金化学式为LaNi5 , 并且一个晶胞储存2× ![]() +8×
+8× ![]() =3个氢气分子,则1molNi原子的合金中储存H2的物质的量为
=3个氢气分子,则1molNi原子的合金中储存H2的物质的量为 ![]() mol=0.6mol,故答案为:0.6mol. (1)V原子为23号元素,根据核外电子排布规律书写价层电子排布式;能量最高的为3d轨道,有5个伸展方向;(2)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族从上到下,元素的第一电离能逐渐减小;根据结构可以看出C原子分别形成单键和双键,则C原子的杂化轨道类型为sp3和sp2;(3)根据氨气的电子式判断N原子的价层电子排布对数目;原子个数相等且价电子数相等的分子或离子为等电子体;(4)①根据晶胞可以看出1个La原子周围距离最近的La原子在顶点上;②根据晶胞可以看出La原子个数为8×
mol=0.6mol,故答案为:0.6mol. (1)V原子为23号元素,根据核外电子排布规律书写价层电子排布式;能量最高的为3d轨道,有5个伸展方向;(2)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族从上到下,元素的第一电离能逐渐减小;根据结构可以看出C原子分别形成单键和双键,则C原子的杂化轨道类型为sp3和sp2;(3)根据氨气的电子式判断N原子的价层电子排布对数目;原子个数相等且价电子数相等的分子或离子为等电子体;(4)①根据晶胞可以看出1个La原子周围距离最近的La原子在顶点上;②根据晶胞可以看出La原子个数为8× ![]() =1,Ni原子个数为8×
=1,Ni原子个数为8× ![]() +1=5,所以合金化学式为LaNi5 , 并且一个晶胞储存2×
+1=5,所以合金化学式为LaNi5 , 并且一个晶胞储存2× ![]() +8×
+8× ![]() =3个氢气分子,据此计算.
=3个氢气分子,据此计算.


科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间的相互关系如下图所示:已知G在生产中可作为一种耐火材料,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素,其中I+B→A+G属于置换反应。(部分反应物、生成物没有列出)。请填写下列空白:

(1)如何检验D中阳离子___________________________________________。
(2)写出反应②的化学方程式:__________________。写出反应④的离子方程式:__________________________。
(3)若D溶液中混有C,用离子方程式表示除去的方法:____________________。
(4)E在空气中变成F的实验现象是_________________________________。
(5)写出反应⑥的化学方程式,并用单线桥标出电子转移的方向和数目:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体A在一定条件下加热分解,产物全是气体。A的分解反应为:2A=B+2C+2D,现测得分解产生的混合气体的密度是相同条件下氢气的d倍,则A的相对分子质量为
A. 2d B. 2.5d C. 5d D. 0.8d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下向体积为2L的恒容密闭容器中充入6molCO2和8mo1H2 , 发生反应:CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49KJmol﹣1 . 测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( ) 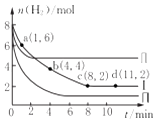
A.该反应在O~8min内的v(CO2)=0.125molL﹣1min﹣1
B.若起始时向容器中充入3mo1CO2和4molH2 , 则平衡时CH3OH的体积分数大于20%
C.若起始时向容器中充入4mo1CO2和2molH2、2molCH3OH、1molH2O(g),则此时反应v(正)>v(逆)
D.曲线II、曲线III改变条件分别是升高温度、减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种新型香料的主要成分之一,其结构中含有三个六元环.G的合成路线如图(部分产物和部分反应条件略去): 
己知:①RCH=CH2+CH2=CHR﹣﹣﹣﹣CH2═CH2+RCH═CHR;
②B的核磁共振氢谱图显示分子中有6 种不同环境的氢原子;
③D和F互为同系物.
(1)(CH3)2C=CH2 , 分子中在同一平面内的原子数最多为 . D分子中含有的含氧官能团名称是 .
(2)A→R反应过程中涉及的反应类型依次为、 .
(3)E的结构简式为 . G的结构简式为 .
(4)B→C的化学方程式为 .
(5)写出同时满足下列条件的F的一种同分异构体的结构简式 . ①能与FeCl3溶液发生显色反应;
②苯环上有两个取代基且能发生水解反应;
③其核磁共振氢谱图中有4 组峰.
(6)模仿由苯乙烯合成F的方法,写出由丙烯制取  的合成路线: .
的合成路线: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为:
1)C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
3)H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为 ![]() ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)元素A、B、C、D分别是:A , B , C , D .
(2)D元素在周期表中属第周期族.
(3)用电子式表示A的气态氢化物的形成过程: .
(4)A和B的单质充分反应生成化合物的电子式是 .
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明; .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于1.5mol 氢气的叙述中,正确的是( )
A. 质量是 4g
B. 体积是 33.6L
C. 电子数是 3
D. 分子数约为1.5×6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4﹣、C2O42﹣三者中所占物质的量分数〔分布系数)随pH变化的关系如图所示.下列表述不正确的是( ) 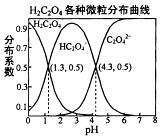
A.HC2O4﹣H++C2O42﹣ , K=1×10﹣4.3
B.将等物质的量的NaHC2O4、NAa2C2O4溶于水中,所得溶液PH恰好为4.3
C.常温下HF的KB=1×10﹣﹣3.45 , 将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F﹣=HF+HC2O4﹣
D.在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com