
【题目】已知下列反应的热化学方程式为:
1)C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
3)H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
(1)该反应是反应(填“吸热”、“放热”).
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”、“不变”),原因是
(3)反应体系中加入催化剂对反应热是否有影响?(填“有”、“无”),原因是 .
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 , E2(填“增大”、“减小”、“不变”). 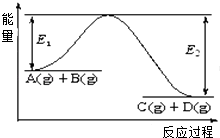
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为:
1)C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
3)H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.
(1)冶炼铜的反应为:8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号).若反应中生成了标况下22.4L气体,转移的电子数目为________。
(2)上述冶炼过程产生大量酸性氧化物SO2,为大气污染物之一。下列处理方案中合理的是________(填代号).
a.高空排放 b.用浓硫酸氧化吸收制硫酸
c.用NaOH溶液吸收制Na2SO3 d.用氨水吸收制氮肥铵盐
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O![]() +2I-=2SO
+2I-=2SO![]() +I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是________.
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水 所选试剂为________.证明炉渣中含有FeO的实验现象为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要的催化剂和合金材料.请回答:
(1)基态V原子的价层电子排布式为;其中能量最高的电子所占用能级的原子轨道有个伸展方向.
(2)VO2+与  可形成配合物.
可形成配合物.  中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
(3)镍形成的Ni(NH3)62+、Ni(CN)42﹣中,NH3分子中N原子的价层电子对数目为 . 写出一种与CN﹣互为等电子体的分子的化学式: .
(4)La﹣Ni合金是重要的储氢材料,储氢后的晶胞如图所示.①合金中,1个La原子周围距离最近切相等的La原子数目为 . ②含有1molNi原子的合金中储存H2的物质的量为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)(1)用胆矾(CuSO4·5H2O)配制0.200mol/L CuSO4溶液240mL,所需要的玻璃仪器为:烧杯、量筒、________________________(要填全),应称取胆矾的质量为____________。
(2)下列操作使所配CuSO4溶液浓度偏低的是____________。
A.观察刻度线时仰视
B.观察刻度线时俯视
C.定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水至标线
D.配制溶液前,容量瓶中有少量蒸馏水
(二)(1)用单线桥标出该反应的电子转移方向和数目,并回答相关问题:
KClO4+8HCl(浓)=KCl+4Cl2↑+4H2O____________,氧化剂与还原剂的物质的量之比为____________。
(2)配平化学方程式(将化学计量数填于空白处)
_____KMnO4+___FeSO4+___H2SO4=___K2SO4+__MnSO4+__Fe2(SO4)3+__H2O
氧化产物与还原产物的物质的量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.08mol气体;
第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
(已知, ![]() +OH-
+OH-![]() H2O+NH3↑)
H2O+NH3↑)
根据上述实验,回答以下问题。
(1)由第一份进行的实验推断该混合物是否一定含有Cl-?____________(答是或否)。
(2)由第二份进行的实验得知混合物中应含有____________(填离子符号),其物质的量浓度为____________。
(3)由第三份进行的实验可知12.54g沉淀的成分为____________。
(4)综合上述实验,你认为以下结论正确的是(______)
A.该混合液中一定含有K+、![]() 、
、![]() 、
、![]() ,可能含Cl-,且n(K+)≥0.04mol
,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含K+、Cl-
,可能含K+、Cl-
C.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
D.该混合液中一定含有![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度不同压强(P1>P2)下,可逆反应2X(g)2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(Z%)与反应时间(t)的关系有以下图示,正确的是( )
A.
B.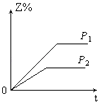
C.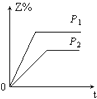
D.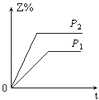
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂(相对分子质量74)广泛应用于化工、冶金等行业.工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如图: 
已知:碳酸锂的溶解度为((g/L)
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
请回答下列问题:
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为
(2)硫酸化焙烧温度控制在250℃﹣300℃之间,主要原因是 . 焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是 .
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有 .
(4)“沉锂”的化学反应方程式为 .
(5)“沉锂”需要在95℃以上进行,主耍原因是 . 过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有和 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com