
【题目】在如图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质。据此填空。
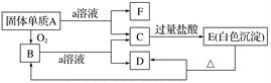
(1)写出各物质的化学式:
A.________、B________、C________、
D.________、E________、F________。
(2)B与a溶液反应的离子方程式是_________。
(3)A与a溶液反应的离子方程式是__________。
【答案】Si SiO2 Na2SiO3 H2O H2SiO3 H2 SiO2+2OH-=SiO32-+H2O Si+2OH-+H2O=SiO32-+2H2↑
【解析】
C中加入过量HCl产生不溶于盐酸的白色沉淀,推知E可能是硅酸,A可能是Si,代入题目验证,a溶液是强碱(如NaOH)溶液或HF溶液,而Si和SiO2与NaOH溶液反应均生成Na2SiO3.Na2SiO3与过量盐酸反应生成NaCl和H2SiO3白色沉淀:H2SiO3![]() SiO2+H2O,与题意相符.Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应.因此A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH),据此回答问题。
SiO2+H2O,与题意相符.Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应.因此A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH),据此回答问题。
(1)由以上分析可知A是Si,B是SiO2,C是Na2SiO3,D是H2O,E是H2SiO3,F是H2;
答案:Si;SiO2;Na2SiO3;H2O;H2SiO3;H2;
(2)B和a溶液反应是二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O;
答案:SiO2+2OH-=SiO32-+H2O
(3)A和a溶液反应是硅和氢氧化钠溶液反应生成硅酸钠和氢气,反应的离子方程式为Si+2OH-+H2O=SiO32+2H2↑;
答案:Si+2OH-+H2O=SiO32+2H2↑


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答:
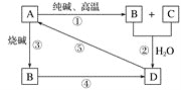
(1)A是______,B是_____,D是_____。
(2)写化学方程式:
①_________;
⑤_________。
(3)写离子方程式:
②__________;
③________;
④________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=-1234.8kJ·mol-1
结论:C2H5OH的燃烧热 △H=-1234.8 kJ·mol-1
B. 稀溶液中有H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1
结论:将稀醋酸与NaOH的稀溶液混合后,若有1 mol H2O生成,则放出的能量等于57.3kJ
C. C(s,石墨)=C(s,金刚石) △H=+1.5kJ·mol-1
结论:相同条件下金刚石比石墨稳定
D. Sn(s,灰)![]() Sn(s,白) △H=+2.1kJ·mol-1(灰锡为粉末状)
Sn(s,白) △H=+2.1kJ·mol-1(灰锡为粉末状)
结论:锡制品在寒冷的冬天更容易损坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)

根据以上信息填空:
(1)写出下列物质的化学式:A______ G__________ ;
(2)纯净的气体甲在气体乙中燃烧的现象:______________________________________;
(3)写出下列反应的离子方程式:反应①_________________________;反应④____________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛的用途。下图是工业制备氢溴酸粗品并精制的流程:(沸点:Br2:58.5℃;HBr:-66.8℃;H2SO4:338℃)

(1)混合①中反应的离子方程式是__________________________________。
(2)混合①中不直接用水而使用冰水的目的是________________________。
(3)操作b适用于______混合物的分离(填序号)。
A.固体和液体 B.固体和固体 C.互不相溶的液体 D.互溶的液体
(4)混合②中加入亚硫酸钠的目的是__________________。
(5)纯净的氢溴酸应为无色液体,但工业生产中制得的氢溴酸(工业氢溴酸)常带有黄色,甲同学猜测可能是含有Fe3+,乙同学猜测可能是含有Br2。请写出证实乙同学猜想的实验方法是________________________。
(6)若起始使用m kg溴单质作原料,完成生产后,得到精制氢溴酸溶液250 L。取2.5 mL精制溶液稀释,在稀释液中加入足量的硝酸银溶液充分反应,若充分反应后得到n g淡黄色沉淀,则单质溴的利用率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,如合成的金刚烷胺就是一种抗病毒药剂,对帕金森症、老年痴呆有良好的疗效.由环戊二烯合成金刚烷的路线如下:
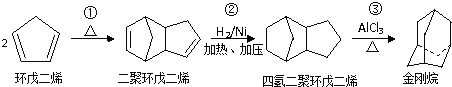
请回答下列问题:
(1)金刚烷的分子式为 ______ .
(2)反应①的反应类型是 ______ .
(3)金刚烷与四氢二聚环戊二烯的关系是 ______ .(填字母)
a 互为同系物 b 互为同分异构体 c 均为烷烃 d 均为环烃
(4)下面是以环戊烷为原料制备环戊二烯的合成路线:
![]()
其中,反应②的反应试剂和反应条件是 ______ ;X的名称是 ______ ;反应④的化学方程式是 ______ ;
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基(-CH3、-CH2R、-CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基],则A的结构有 ______ 种(不考虑立体异构),其中核磁共振氢普为5组峰,且面积比为4:1:2:2:3的结构简式是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据SO2通入不同溶液中的实验现象,所得结论不正确的是( )
溶液 | 现象 | 结论 | |
A | 含HCl,BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2是酸性氧化物 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有还原性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环中不存在碳碳单键和碳碳双键交替的结构,可以作为证据的事实是( )
①苯是无色易挥发的液体;
②苯不能使酸性高锰酸钾溶液褪色;
③![]() 和
和 是同一种物质。
是同一种物质。
A. ①②③ B. ①和② C. ①和③ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】感光性高分子又称为“光敏性高分子”,是一种在彩电荧光屏及大规模集成电路制造中应用较广的新型高分子材料,其结构简式为 。
。
试回答下列问题:
(1)该物质的单体是______。
(2)在一定条件下,该高聚物可发生的反应有__________(填序号)。
①加成反应 ②氧化反应 ③取代反应 ④酯化反应
(3)该高聚物在催化剂的作用下,水解后得到相对分子质量较小的产物为A,则:
①A的分子式是_____。
②A在一定条件下与乙醇反应的化学方程式是________。
③A的同分异构体有多种,其中含有苯环、![]() 和
和![]() ,且苯环上有两个对位取代基的结构简式是_______、______。
,且苯环上有两个对位取代基的结构简式是_______、______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com