
【题目】工业上常用铁质容器盛装冷浓硫酸。某学习小组为研究铁质材料与热浓硫酸的反应,设计了以下探究活动:
称取铁钉(碳素钢)6.0 g放入15.0 mL浓硫酸中,加热,充分应后得到溶液M并收集到气体N。
(1)该小组通过认真分析,认为M溶液中既含有Fe3+,也可能含有Fe2+。若确认溶液中有无Fe2+,应加入的试剂是___________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.NaOH溶液 d.酸性KMnO4溶液
(2)取320 mL(标准状况)气体N通入足量溴水中,然后加入足量BaCl2溶液,经过____________ 、______________(填操作名称)、干燥后,得到固体2.33 g。气体N与溴水反应的化学方程式为_______________,计算推知气体N中SO2的体积分数为_______________。
(3)该小组通过对铁钉的成分和SO2体积分数的分析,认为气体N中还可能含有H2和另外一种气体Q。你认为Q应该是_____________,理由是________________(用化学方程式表示)。
(4)取一定量N,利用下列仪器设计一个能同时检验N中含有H2和气体Q的装置(夹持仪器、橡胶管和加热装置省略),仪器的连接顺序是_____________(填字母),其中A的作用是_____________,B中试剂X的化学式是_____________________。
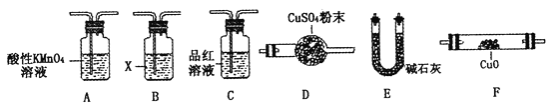
【答案】d 过滤 洗涤 SO2+Br2+2H2O=H2SO4+2HBr 70% CO2 C + 2H2SO4 (浓)![]() 2SO2↑+ CO2↑+ 2H2O A-C-B-E-F-D(或A-C-B-E-F-D-E) 除去N中的SO2, Ca(OH)2 或Ba(OH)2
2SO2↑+ CO2↑+ 2H2O A-C-B-E-F-D(或A-C-B-E-F-D-E) 除去N中的SO2, Ca(OH)2 或Ba(OH)2
【解析】
(1)Fe+2Fe3+=3Fe2+,+2价亚铁离子能使酸化的高锰酸钾褪色,溶液中已经有+3价铁离子,选择a会造成干扰,选b只能检验溶液中含有+3价铁离子,选c会造成两种沉淀,受氢氧化铁颜色的影响无法辨别,只能选d,故答案为:d;
(2)SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,生成的硫酸遇到氯化钡会产生白色沉淀,可以先洗涤然后再过滤来获得纯净的硫酸钡沉淀,则n(混合气体)=![]() ≈0.014mol,
≈0.014mol,
SO2~BaSO41mol 233g
n 2.33g
n=0.01mol
则SO2的体积分数:![]() ×100%≈70%,故答案为:过滤;洗涤;SO2+Br2+2H2O=2HBr+H2SO4;70%;
×100%≈70%,故答案为:过滤;洗涤;SO2+Br2+2H2O=2HBr+H2SO4;70%;
(3)在反应的过程中,碳单质可以和浓硫酸反应生成二氧化碳、二氧化硫等气体,故答案为:CO2;C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(4)推断所的气体中可能含有二氧化碳,结合图中设计装置的目的,可知检验二氧化碳的方法是首先将二氧化硫除去→确认二氧化硫已经完全除去→澄清石灰水,对于氢气的检验则可通过与灼热氧化铜的反应现象和对产物水的验证来实现,验证气体存在的顺序为:SO2→CO2→CO和H2被氧化→H2O→CO2,实验中要避免其它物质的性质干扰,顺序为:A-C-B-E-F-D(或A-C-B-E-F-D-E),其中A酸性高锰酸钾溶液的作用是除去二氧化碳中的SO2,B中试剂X的作用是除去二氧化硫,可以用Ca(OH)2或Ba(OH)2,
故答案为:A-C-B-E-F-D(或A-C-B-E-F-D-E);除去N中的SO2;Ca(OH)2或Ba(OH)2.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列判断正确的是( )
A.NA个O2和28g N2所占的体积都约为22.4 L
B.标准状况下,22.4 L H2O含有NA个水分子
C.71g Cl2与足量NaOH溶液反应,转移的电子数为2NA
D.1.8g的NH4+ 离子中含有的电子数NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上可用含SiO2、CeO2和Fe2O3的废料作原料来获得硫酸铁铵晶体(Fe2(SO4)3·2(NH4)2 SO4·3H2O),同时可回收CeO2,工艺流程设计如下
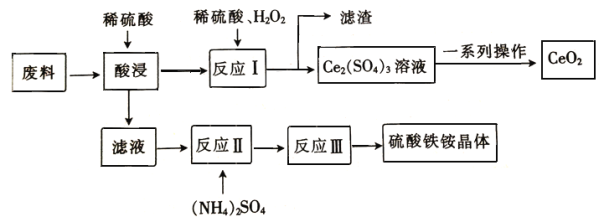
已知: ①SiO2、CeO2不溶于稀硫酸;②酸性条件下,CeO2可与H2O2反应;③“反应Ⅰ”所得溶液中含有Ce3+;④碱性条件下,NH4+与OH-结合生成NH3·H2O。
请回答下列问题
(1)“酸浸”时未发生的反应 物质是__________________(填化学式)。
(2)“滤液”中含有的阳离子有___________________(填离子符号)。
(3)写出“反应Ⅰ”的化学方程式:________________________________________。
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是__________________(填化学式)。
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为有机物,其中A是常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如下转化关系。请回答下列问题:
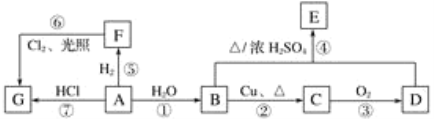
(1)写出A、D、G的结构简式:A________;D________;G________。
(2)A、B中官能团的名称:A________;B_________。
(3)在F的同系物中最简单的有机物的空间构型为____________。
(4)与F互为同系物且含有5个碳原子的同分异构体共有______种。
(5)写出下列编号对应反应的化学反应方程式,并注明反应类型:
①____________、________反应;
②___________________________________________、________反应;
④_________________________________________、________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,一定量的二氧化硫与1.100mol氧气在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A. 三氧化硫生成的速率与二氧化硫消耗的速率相等时反应达到平衡
B. 降低温度,正反应速率减小,逆反应速率增大
C. 平衡混合气体通入过量氯化钡溶液中,得到沉淀的质量为161.980g
D. 达到平衡时,二氧化硫的转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L密闭容器里发生4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)反应半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的速率可表示为( )
4NO(g)+6H2O(g)反应半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的速率可表示为( )
A. v(O2)=0.0010mol·L-1·s-1B. v(NH3)=0.00125mol·L-1·s-1
C. v(H2O)=0.0010mol·L-1·s-1D. v(NO)=0.0010mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
B.1molCl2与足量Fe反应,转移的电子数为3NA
C.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
D.在H2O2+Cl2=2HCl+O2反应中,每生成32g 氧气,转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是![]() ,含
,含![]() 、
、![]() 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
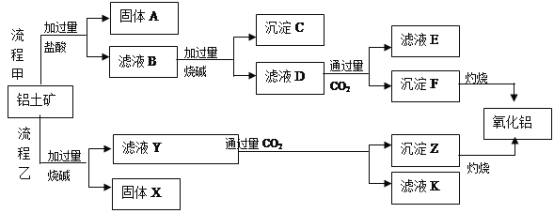
请回答下列问题:
(1)流程乙加入烧碱后的离子方程式为_________________________________________.
(2)固体A的应用_________________________________________.(两点)
(3)滤液D与少量CO2反应的离子方程式为__________________________________,
向该滤液K中加入足量石灰水的离子方程式是________
(4)流程乙制氧化铝的优点是所用的试剂较经济,缺点是__________________________
(5)已知298K时,![]() 的溶度积常数
的溶度积常数![]() =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的pH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的pH最小为_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如右图所示,具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是( )

A. 该物质既可看做醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com