
【题目】在工业上可用含SiO2、CeO2和Fe2O3的废料作原料来获得硫酸铁铵晶体(Fe2(SO4)3·2(NH4)2 SO4·3H2O),同时可回收CeO2,工艺流程设计如下
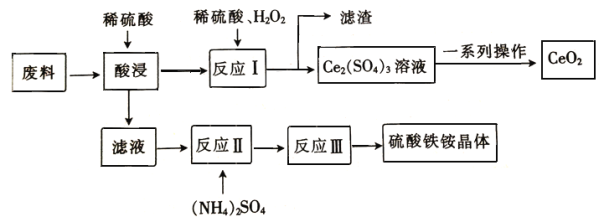
已知: ①SiO2、CeO2不溶于稀硫酸;②酸性条件下,CeO2可与H2O2反应;③“反应Ⅰ”所得溶液中含有Ce3+;④碱性条件下,NH4+与OH-结合生成NH3·H2O。
请回答下列问题
(1)“酸浸”时未发生的反应 物质是__________________(填化学式)。
(2)“滤液”中含有的阳离子有___________________(填离子符号)。
(3)写出“反应Ⅰ”的化学方程式:________________________________________。
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是__________________(填化学式)。
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:_____________________。
【答案】CeO2和SiO2 H+、Fe3+ 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O H2O2 Fe3++2NH4++5OH-=Fe(OH)3↓+2NH3H2O
【解析】
废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)中加入稀硫酸,Fe2O3转化Fe2(SO4)3存在于滤液中,反应Ⅰ中含CeO2和SiO2,向反应Ⅰ加入稀硫酸和H2O2,CeO2转化为Ce3+存在于滤液中,反应为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,滤渣为SiO2,并利用氧气将Ce从+3氧化为+4后Ce (OH)3转化为沉淀Ce(OH)4,反应为:4Ce (OH)3+O2+2H2O═4Ce(OH)4,加入分解Ce(OH)4得到产品CeO2,向滤液Fe2(SO4)3中加入硫酸铵经反应,并蒸发浓缩、常温晾干后得到硫酸铁铵晶体。
(1)“酸浸”时未发生的反应物质是CeO2和SiO2,
故答案为:CeO2和SiO2;
(2)加入稀硫酸,Fe2O3转化Fe2(SO4)3存在于滤液中,故“滤液”中含有的阳离子有H+、Fe3+,
故答案为:H+、Fe3+;
(3)反应Ⅰ是CeO2转化为Ce3+存在于滤液中,反应为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,反应的离子方程式:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,
故答案为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
(4)在酸性条件下,发生的反应为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,氧化剂的氧化性强于还原剂,在该反应中Ce从+4降低到+3,化合价降低作氧化剂,H2O2中O从-1价升高到0价,作还原剂,故CeO2氧化性强于H2O2,故氧化性较弱的是H2O2,
故答案为:H2O2;
(5)往硫酸铁铵溶液中加入过量的NaOH,该反应的离子方程式为Fe3++2NH4++5OH-=Fe(OH)3↓+2NH3H2O,
故答案为:Fe3++2NH4++5OH-=Fe(OH)3↓+2NH3H2O。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是( )
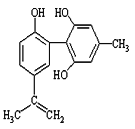
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子可能共平面
D.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为1mol和7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
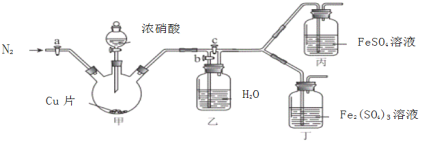
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
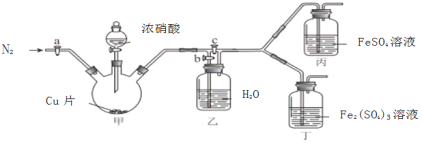
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C3H6O2, 其1H核磁共振谱如下图,则该有机物的结构简式为( )
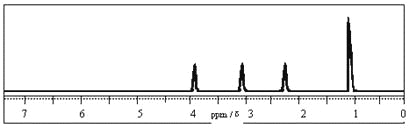
A. CH3COOCH3B. HCOOC2H5
C. CH3COCH2OHD. CH3CH(OH)CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁煅烧反应为2FeSO4(s)![]() X(g)+Fe2O3(s)+SO3(g),有关说法正确的是
X(g)+Fe2O3(s)+SO3(g),有关说法正确的是
A. 该反应中X为还原产物
B. X能使溴水退色,说明X具有漂白性
C. 该反应中每生成1 mol Fe2O3转移电子数约为6.02×1023
D. 该反应生成的气体通入足量Ba(NO3)2溶液中,可得到两种沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的废水中含有氰化物,可在碱性条件下对氰化物进行净化处理:2CN-+8OH- +5C12=2CO2+N2+10Cl-+4H2O。下列分析中错误的是( )
A.当反应消耗0.2 mol CN-时,反应中转移电子的物质的量是1 mol
B.还原性:CN->Cl-
C.CN-的电子式为![]()
D.该反应中氧化剂和还原剂的物质的量之比是2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸。某学习小组为研究铁质材料与热浓硫酸的反应,设计了以下探究活动:
称取铁钉(碳素钢)6.0 g放入15.0 mL浓硫酸中,加热,充分应后得到溶液M并收集到气体N。
(1)该小组通过认真分析,认为M溶液中既含有Fe3+,也可能含有Fe2+。若确认溶液中有无Fe2+,应加入的试剂是___________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.NaOH溶液 d.酸性KMnO4溶液
(2)取320 mL(标准状况)气体N通入足量溴水中,然后加入足量BaCl2溶液,经过____________ 、______________(填操作名称)、干燥后,得到固体2.33 g。气体N与溴水反应的化学方程式为_______________,计算推知气体N中SO2的体积分数为_______________。
(3)该小组通过对铁钉的成分和SO2体积分数的分析,认为气体N中还可能含有H2和另外一种气体Q。你认为Q应该是_____________,理由是________________(用化学方程式表示)。
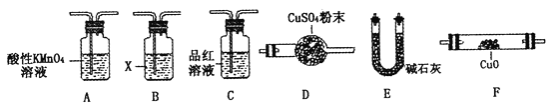
(4)取一定量N,利用下列仪器设计一个能同时检验N中含有H2和气体Q的装置(夹持仪器、橡胶管和加热装置省略),仪器的连接顺序是_____________(填字母),其中A的作用是_____________,B中试剂X的化学式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填写下列内容:
(1)2.5molH2SO4的质量是___;
(2)H3PO4的摩尔质量为___;
(3)等质量的氧气和臭氧,他们原子的个数之比为___;
(4)6.02×1023个N2所含___mol质子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com