
【题目】从葡萄籽中提取的原花青素结构如右图所示,具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是( )

A. 该物质既可看做醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
科目:高中化学 来源: 题型:
【题目】A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,B和X均可与A形成10电子的化合物;B与Z的最外层电子数之比为2:3,化合物Y2X2与水反应生成X的单质,所得溶液可使酚酞变红。请回答下列问题。
(1)Z的原子结构示意图为_______,化合物BA4的电子式为__________。
(2)化合物Y2X2中含有的化学键类型有________________________。
(3)化合物A2X和A2Z中,沸点较高的是_________(填化学式),其主要原因是______。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上通常把原子数和电子数相等的分子或离子称为等电子体,人们发现等电子体间的结构和性质相似(即等电子原理),B3N3H6被称为无机苯,它与苯是等电子体,则下列说法中不正确的是
A. 无机苯是由极性键组成的非极性分子
B. 无机苯能发生加成反应和取代反应
C. 无机苯不能使KMnO4酸性溶液褪色
D. 无机苯的二氯取代物有3种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+2B(g)![]() 2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
(1)升高温度,B的转化率___________,v(正)__________。
(2)使用催化剂,A的物质的量___________。
(3)增大压强,v(逆)___________,C的产率___________。
(4)增大A的浓度,则B的转化率____________,C的物质的量_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
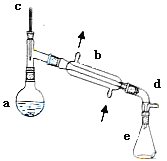
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
![]()
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________。
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________。(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________。
(4)在本实验的分离过程中,产物应从分液漏斗的____________。(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是____________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。(填正确答案标号)
A.圆底烧瓶 B.温度计 C.吸滤器 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________。(填正确答案标号)
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素也与碳元素一样存在一系列氢化物,如NH3、N2H4、N3H5、N4H6等。请回答下列有关问题:
(1)上述氮的系列氢化物的通式为____________。
(2)已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,查阅文献资料,化学键键能如下表:
化学键 | H-H | N=N | N-H |
E/kJ·mol-1 | 436 | 946 | 391 |
①氨分解反应NH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应
H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea2=___________。
NH3(g)的活化能Ea2=___________。
②氨气完全燃烧生成氮气和气态水的热化学方程式为__________________________。
③如右图是氨气燃料电池示意图。a电极的电极反应式为________________。
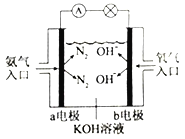
(3)已知NH3·H2O为一元弱碱。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为:N2H4·H2O+H2O![]() N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为__________________;溶液中离子浓度由大到小的排列顺序为___________________。
N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为__________________;溶液中离子浓度由大到小的排列顺序为___________________。
(4)通过计算判定(NH4)2SO3溶液的酸碱性(写出计算过程)________________________。(已知:氨水Kb=1.8×10-5;H2SO3 Ka1=1.3×10-2Ka2=6.3×10-8)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=______________已知:K300℃>K350℃,则该反应是_______热反应图中表示NO2变化的曲线是__________上述反应在第5s时,NO的转化率为_________。
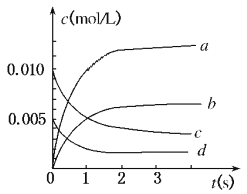
(2)能说明该反应已达到平衡状态的是__________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁子香酚可用于制备杀虫剂和防腐剂,结构简式如右下图所示。下列说法中,不正确的是

A. 丁子香酚可通过加聚反应生成高聚物
B. 丁子香酚分子中的含氧官能团是羟基和醚键
C. 1 mol丁子香酚与足量氢气加成时,最多能消耗4 mol H2
D. 丁子香酚能使酸性KMnO4溶液褪色,可证明其分子中含有碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com