
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
【答案】C
【解析】
A.反应前2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,故v(Y)= ![]() =0.002mol/(Lmin),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(Lmin)=0.004mol/(Lmin),故A错误;
=0.002mol/(Lmin),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(Lmin)=0.004mol/(Lmin),故A错误;
B.正反应放热,降低温度平衡正向移动,其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正),故B错误;
C.由表中数据可知7min时,反应到达平衡,平衡时Y的物质的量为0.10mol,则:
X(g) + Y(g) 2Z(g)
开始(mol):0.16 0.16 0
变化(mol):0.06 0.06 0.12
平衡(mol): 0.1 0.1 0.12
由于反应前后气体的化学计量数相等,用物质的量代替浓度进行计算,故化学平衡常数k=![]() 1.44,故C正确;
1.44,故C正确;
D.再通入0.2molZ,等效为在原平衡基础上增大压强,反应前后气体的体积不变,平衡不移动,X的体积分数不变,故D错误;
本题答案选C。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】将2.7g铝和4.6g钠同时加入足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法中正确的是( )
A. 反应中放出的气体在标准状况下的体积为2.24 L
B. 参加反应的水的质量与加入铝的质量相等
C. 所得溶液中钠离子和铝离子物质的量之比为2∶1
D. 所得溶液中阳离子和阴离子的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菲斯科(FiskerInc.)公司宣布正在开发的固态锂电池能量密度是现有电池的2.5倍,续航里程可达500英里(约804公里),最快充电时间可以分钟计,钴酸锂(LiCoO2) 电池的工作原理如图所示,M极材料是金属锂和碳的复合材料(碳作金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过。下列说法正确的是
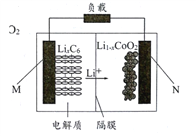
A. 电池的总反应式为:LixC6+Li1-xCoO2==C6+LiCoO2
B. M为电池的正极
C. 放电时,N为负极,电极发生氧化反应
D. 充电时,M为阳极,电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和硫酸亚铁、浓硫酸和硝酸钾反应可以制得纯度为98%的NO,其反应为FeSO4+KNO3+H2SO4(浓)![]() Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
A. 该反应的氧化剂是KNO3
B. 氧化产物与还原产物的物质的量之比为2∶3
C. Fe2(SO4)3、K2SO4、H2O均为电解质
D. 该反应中生成144gH2O,转移电子的物质的量为12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2种常见元素组成的化合物G,有关转化和实验信息如下:
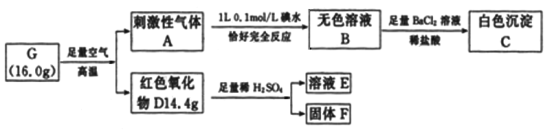
请回答下列问题:
(1)G是______________(填化学式)。
(2)写出A→B的离子方程式_____________________________________________。
(3)若D为纯净物,F是红色金属单质,写出D和稀硫酸反应的离子方程式_____________。
(4)C的最大质量为________________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出NaHCO3在水中的电离方程式:______________;NaOH溶液与NaHCO3溶液反应的离子方程式:________________。
(2)某无色透明溶液中可能大量存在NH4+、Na+、Ba2+、Fe3+、CO32-、SO42-、Cl-中的几种离子。从其中取两份各100mL溶液,进行如下实验:
①根据溶液颜色可以判断溶液中不存在的离子是_____________;
②取其中的一份溶液进行实验,加入过量氢氧化钠浓溶液并加热,共生成448mL气体(标准状况下),有关的离子方程式为______________;
③取另一份溶液加入过量Ba(NO3)2溶液,生成3.94g白色沉淀,过滤,向沉淀中再加入足量稀盐酸,沉淀全部溶解;根据以上实验结果确定:原溶液中肯定存在的离子有___________;请你设计实验方案证明该溶液中是否含有Cl-?_____________ 。
(3)某氮肥厂的氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在。该厂的技术团队设计该废水处理方案流程如下:
![]()
①过程Ⅱ:在微生物的作用下实现NH4+→NO2-→NO3-转化,称为硝化过程。在碱性条件下,NH4+被氧气(O2)氧化成NO3-的总反应的离子方程式为________________。
②过程Ⅲ:在一定条件下向废水中加入甲醇(CH3OH),实现HNO3→NO2-→N2转化,称为反硝化过程。反硝化过程中甲醇(C元素为-2价)转化为CO2,若有6molHNO3完全转化成N2,消耗的甲醇的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列判断正确的是( )
A.NA个O2和28g N2所占的体积都约为22.4 L
B.标准状况下,22.4 L H2O含有NA个水分子
C.71g Cl2与足量NaOH溶液反应,转移的电子数为2NA
D.1.8g的NH4+ 离子中含有的电子数NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基本知识填空
(1)在一定条件下,当一个可逆反应的_____与____相等时,反应物的浓度与生成物的浓度不再改变,即达到化学平衡状态。
(2)化学平衡状态的特征:_____、____、_____、_____、_____。
(3)对于可逆化学反应mA+nBpC+qD在一定温度下达到化学平衡时,其平衡常数表达式为:______。
(4)强电解质包括的范围:____、____、____。弱电解质包括的范围:____、_____、____、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为有机物,其中A是常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如下转化关系。请回答下列问题:
(1)写出A、D、G的结构简式:A________;D________;G________。
(2)A、B中官能团的名称:A________;B_________。
(3)在F的同系物中最简单的有机物的空间构型为____________。
(4)与F互为同系物且含有5个碳原子的同分异构体共有______种。
(5)写出下列编号对应反应的化学反应方程式,并注明反应类型:
①____________、________反应;
②___________________________________________、________反应;
④_________________________________________、________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com