
【题目】化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198P—O:360O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为 ( )
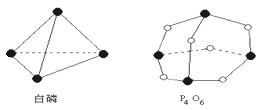
A. -1638 kJ·mol-1B. +1638 kJ·mol-1C. -126 kJ·mol-1D. +126 kJ·mol-1
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
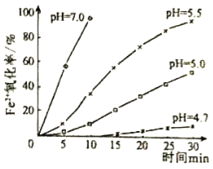
【题目】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。回答下列问题:
(1)写出Fe2+水解的离子方程式______;要抑制FeSO4水解,可以采取的措施是______。
(2)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O24Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是______。
a.Fe2+转化为Fe3+的趋势很大 b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全 d.酸性条件下Fe2+不会被氧化
(3)结合如图分析不同pH对Fe2+被O2氧化的反应发生了怎样的影响______。
(4)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是______。
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O若取20mL待测溶液,用0.0200molL-1KCr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=______molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]
氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年中国水周的主题是:“节约保护水资源,大力建设生态文明”.
(1)ClO2和Cl2(还原产物都为Cl﹣)是生活中常用的净水消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_________倍.
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作流程和有关现象如图所示:操作③的相关图象如图
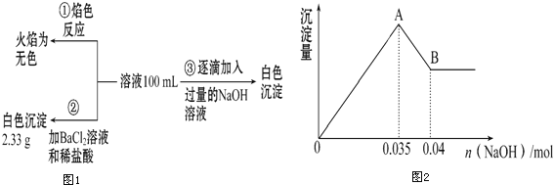
请根据上图回答下列问题:
①实验中需配制1.0molL﹣1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_______________.
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为___________.
③试确定NO3-是否存在?________(填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-)=_____(若不存在,此问不必作答).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
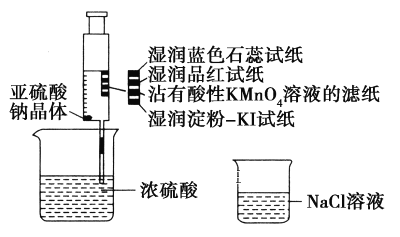
A. 蓝色石蕊试纸先变红后褪色
B. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
C. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
D. NaCl溶液可用于除去实验中多余的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体。CO2与化合物Ⅰ反应生成化合物Ⅱ,与化合物Ⅲ反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略)。
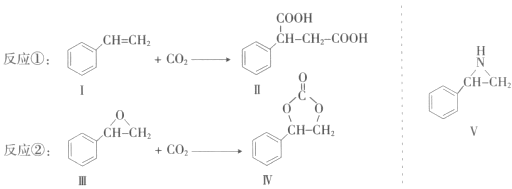
(1)化合物Ⅰ的分子式为______,1 mol该物质完全燃烧需消耗_______mol O2 。
(2)由![]() 通过消去反应制备Ⅰ的化学方程式为________(注明反应条件)。
通过消去反应制备Ⅰ的化学方程式为________(注明反应条件)。
(3)Ⅱ与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为________。
(4)在一定条件下,化合物V能与CO2发生类似反应②的反应,生成两种化合物(互为同分
异构体),请写出其中任意一种化合物的结构简式:________。
(5)与CO2类似,CO也能被固定和利用。在一定条件下,CO、![]() 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有________(双选,填字母)。
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有________(双选,填字母)。
A.都属于芳香烃衍生物 B.都能使溴的四氯化碳溶液褪色
C.都能与Na反应放出H2 D.1molⅥ或Ⅶ最多能与4molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Cu和CuO的混合物中加入0.6 L 2.0 mol/L的稀硝酸,混合物完全溶解,同时生成标准状况下NO 4.48 L。向所得溶液中加入一定体积1.0 mol/L NaOH溶液,恰好使Cu2+完全沉淀,将沉淀洗涤,充分灼烧后得32.0 g固体。求:
(1)混合物中Cu的质量是____________。
(2)混合物消耗HNO3的物质的量是____________。
(3)NaOH溶液的体积是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
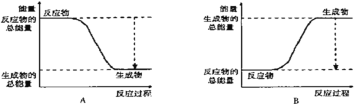
【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O
(1)为了加快该反应速率,不能采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度 C.扩大容器的体积 D.适当降低反应的温度
(2)该反应属于______反应(填“吸热”和“放热”)。
下图能正确表示该反应中能量变化的是________。
(3)氢氧燃料电池如图所示:
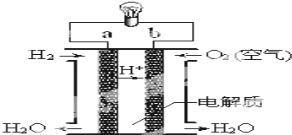
①a为________(填“正极”或“负极”),b电极发生_____反应(填“氧化”或“还原”);
②外电路中电子从b电极___,(填“流入”或“流出”),内电路中阳离子移向____极 (填”a”或”b”);
③写出该装置中正极上的电极反应式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应。常温下,金属D单质投入水中能与水剧烈反应。常温下E单质是常见的气体。请按要求回答下列几个问题:
(1)B、D的元素名称分别为:________、________。
(2)E在周期表中的位置为:________。
(3)C离子的结构示意图为:________。
(4)B、C、D三种元素的原子半径从大到小的顺序为________(用元素符号表示)。
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:________(用对应的化学式表示)。
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com