
【题目】痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为: HUr(aq)+ Na+(aq) ![]() NaUr(s) + H+(aq) +Q (Q>0),下列说法错误的是
NaUr(s) + H+(aq) +Q (Q>0),下列说法错误的是
A.寒冷季节更易诱发关节疼痛
B.饮食中摄入过多食盐,会加重痛风病病情
C.大量饮水会增大痛风病发作的可能性
D.患痛风病的人应少吃能代谢产生更多尿酸钠的食物
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十八大以来,各地重视“蓝天保卫战”战略。作为煤炭使用大国,我国每年煤炭燃烧释放出的大量SO2严重破坏生态环境。现阶段主流煤炭脱硫技术通常采用石灰石-石膏法将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g) ![]() CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
请回答下列问题:
(1)反应CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g);△H=__________kJmol-1;该反应在________(填“高温”“低温”“任意温度”)可自发进行。
(2)恒温密闭容器中,加入足量CaSO4和一定物质的量的CO气体,此时压强为p0。tmin中时反应达到平衡,此时CO和CO2体积分数相等,CO2是SO2体积分数的2倍,则反应I的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
(3)图1为1000K时,在恒容密闭容器中同时发生反应I和II,c(SO2)随时间的变化图像。请分析图1曲线中c(SO2)在0~t2区间变化的原因___________________。

(4)图2为实验在恒容密闭容器中,测得不同温度下,反应体系中初始浓度比![]() 与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
A.当气体的平均密度不再变化,反应I和反应Ⅱ同时达到平衡状态
B.提高CaSO4的用量,可使反应I正向进行,SO2体积分数增大
C.其他条件不变,升高温度,有利于反应I正向进行,SO2体积分数增大,不利于脱硫
D.向混合气体中通入氧气(不考虑与SO2反应),可有效降低SO2体积分数,提高脱硫效率
(5)图1中,t2时刻将容器体积减小至原来的一半,t3时达到新的平衡,请在图1中画出t2-t3区间c(SO2)的变化曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲池为______(填原电池、电解池或电镀池),通入甲醇电极的电极反应式为________。
(2)乙池中B电极为______(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为________。
(3)当乙池中B极质量增重5.4g时,甲池中理论上消耗O2的体积为______mL(标准状况)。
(4)丙池中,C上的电极反应式为________________。如果起始时盛有1000 mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入_____(填物质名称),其质量约为_______g。
(5)若将丙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6g甲醇时,丙中两个电极质量差为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
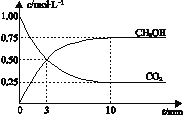
A. 升高温度能使![]() 增大
增大
B. 反应达到平衡状态时,CO2的平衡转化率为75%
C. 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D. 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是

A.因为两种酸溶液的pH相等,故V1一定等于V2
B.若V1>V2,则说明HA为强酸,HB为弱酸
C.若实验①中,V=V1,则混合液中c(Na+)=c(A-)
D.实验②的混合溶液,可能溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、氯气是中学实验室常见气体,在实验室可以利用该反应2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O,制备Cl2,并在实验室模拟工业制备盐酸,请回答下列问题:
(1)甲组同学用下列装置制取H2和Cl2。

①实验室常用NaCl+H2SO4(浓)→NaHSO4+HCl↑反应制备HCl气体,该反应利用了浓硫酸的___性。
②用工业级锌粒(主要成分 Zn,含少量 FeS、Pb、Cu 等杂质)作原料,装置 I、Ⅱ均可以制取 H2,但装置 I 比装置Ⅱ更好,理由__________________________;检验氯气所用的试纸是_______________。
(2)乙组同学拟用甲组的装置 I、Ⅲ及下列装置(可以重复选用)模拟工业上制取盐酸。

①乙组中氢气的部分实验装置连接是a-f-g-d……,其中装置Ⅴ的作用是_______,制取氯气并模拟合成盐酸的实验装置的合理连接顺序(用玻璃接口表示)为 c-__________。
②装置VII中仪器 X 的名称是_________ ,合成 HCl时需控制H2的体积略大于Cl2的体积,其目的是 ________;装置VII末端接抽气水泵的目的是___________。
(3)设计实验证明HCl极易溶于水且水溶液呈酸性:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的
A.甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+ 2H2O(g)△H=-890 kJ/mol
B.在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H=-158.4kJ·mol-1
2SO3(g) △H=-158.4kJ·mol-1
C.NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1
D.2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com