
| A. | CCl2F2 | B. | 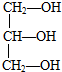 | C. | CH3CH2OH | D. | 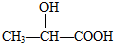 |
分析 有机化合物分子中碳原子连四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子),以*C表示,具有手性碳原子的有机物具有光学活性,据此进行解答.
解答 解:A.CCl2F2分子中C原子连接了2个F和2个Cl,不满足手性碳原子的条件,故A错误;
B.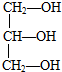 分子中,两端C上都含有相同的2个H原子,中间C上连接了2个-CH2OH,所以丙三醇不具有手性碳原子,故B错误;
分子中,两端C上都含有相同的2个H原子,中间C上连接了2个-CH2OH,所以丙三醇不具有手性碳原子,故B错误;
C.CH3CH2OH分子中2个C原子分别连接了3个、2个H原子,不满足手性碳原子的条件,故C错误;
D.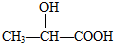 分子中,中间C原子上分别连接了1个-CH3、-OH、H和-COOH,所以该有机物分子中含有手性碳原子,故D正确;
分子中,中间C原子上分别连接了1个-CH3、-OH、H和-COOH,所以该有机物分子中含有手性碳原子,故D正确;
故选D.
点评 本题考查了手性碳原子的概念及判断,题目难度不大,明确有机物分子中含有手性碳原子的条件为解答关键,注意掌握手性碳原子的概念及判断方法,试题培养了学生的灵活应用能力.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:填空题
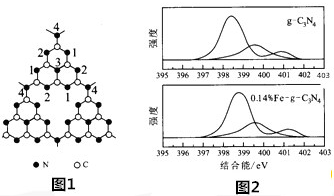 g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.
g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.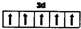 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/mol•L-1 | 6 | 3 | 2 | 2 |
| c(B)/mol•L-1 | 5 | 3.5 | 3 | 3 |
| c(C)/mol•L-1 | 1 | 2.5 | 3 | 3 |
| A. | 在容器中发生的反应为2A+B?2C | |
| B. | 该温度下,此反应的平衡常数为0.25 | |
| C. | A的平衡转化率比B的平衡转化率低 | |
| D. | 起始加入的A、B物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
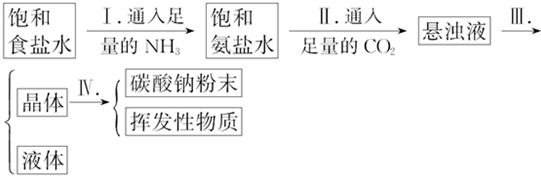
| 温度 盐的溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
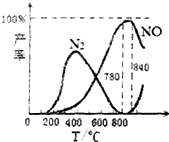
| A. | N2(g)+O2(g)?2NO(g)△H=+181.5kJ/mol | |
| B. | NH3的燃烧热为226.25kJ/mol | |
| C. | 工业上氨催化氧化生成NO时,温度应控制在780~840℃之间 | |
| D. | 用铂丝做催化剂,利用反应①来制备硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热 | |
| B. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | KOH(aq)+HNO3(aq)═KNO3+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热) | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使酸性高锰酸钾溶液褪色 | |
| B. | SO2使滴有酚酞的氢氧化钠溶液褪色 | |
| C. | SO2使品红溶液褪色 | |
| D. | SO2使溴水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com