
| 温度 盐的溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
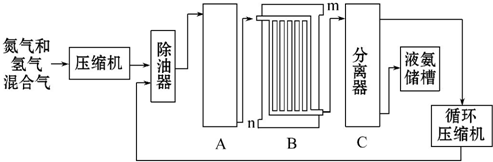
分析 (1)提高N2的转化率,从平衡正向移动分析;
(2)设备B的名称是冷却塔(或冷凝器);设备C的作用是将液氨与未反应的原料气分离;
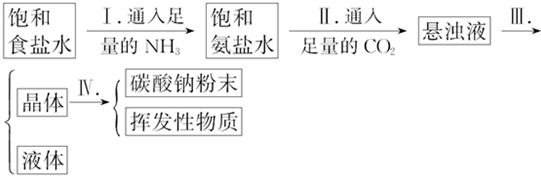
(3)加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述化学平衡向左移动,又产生HClO,起杀菌作用;
(4)二氧化碳的溶解度较小,通入氨气使溶液呈碱性,增加了二氧化碳的溶解度,便于析出NaHCO3晶体;分离固体和液体的操作是过滤;
(5)检验是否含氯化钠用稀硝酸和硝酸银溶液;
(6)若高于35℃,则NH4HCO3分解,若低于30℃,则反应速率降低,采取的加热方法应为水浴加热.
解答 解:(1)从平衡移动原理上分析增大H2的浓度、及时将NH3从混合气体中分离出来或增大压强均可提高N2的转化率,
故答案为:增大H2的浓度;及时将NH3从混合气体中分离出来;
(2)设备B的名称是冷却塔(或冷凝器),设备C的作用是将液氨与未反应的原料气分离,
故答案为:冷却塔(或冷凝器);将液氨与未反应的原料气分离;
(3)对于可逆反应:NH3+HClO?H2O+NH2Cl,加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述化学平衡向左移动,又产生HClO,起杀菌作用,
故答案为:加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述化学平衡向左移动,又产生HClO,起杀菌作用;
(4)二氧化碳的溶解度较小,中性的氯化钠溶液不易吸收二氧化碳,通入氨气后,溶液呈碱性,增加了二氧化碳的溶解度,利用吸收二氧化碳气体,以便生成碳酸氢钠,若Ⅰ、Ⅱ颠倒,则得不到浓的NH4HCO3溶液,便不能析出NaHCO3晶体;分离固体和液体的操作是过滤,
故答案为:若Ⅰ、Ⅱ颠倒,则得不到浓的NH4HCO3溶液,便不能析出NaHCO3晶体;过滤;
(5)检验是否含氯化钠用稀硝酸和硝酸银溶液,产生不溶的白色沉淀,说明溶液在含氯化钠,
故答案为:稀硝酸和硝酸银溶液;
(6)若高于35℃,则NH4HCO3分解,若低于30℃,则反应速率降低,采取的加热方法应为水浴加热,
故答案为:NH4HCO3;反应速率降低;水浴加热.
点评 本题考查工业合成氨、侯氏制碱的方法,用化学平衡移动知识指导实际生产,学生要能学以致用,提高化学学科素养,增强综合素质,题目难度适中.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+8+m-n | B. | a+18-m+n | C. | a+32-m-n | D. | a+24-m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
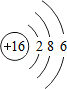 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化石油气、汽油、柴油和润滑油的主要成分都是碳氢化合物 | |
| B. | 可以通过灼烧时的特殊气味来鉴别蛋白质 | |
| C. | 用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯 | |
| D. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com