
| A. | a+8+m-n | B. | a+18-m+n | C. | a+32-m-n | D. | a+24-m-n |
分析 同周期的两种主族元素A和B能够形成离子化合物AmBn,则A为金属元素,B为非金属元素,已知A的原子序数为a,则离子中A少了一个电子层,B的电子层不变,以此来解答.
解答 解:同周期的两种主族元素A和B能够形成离子化合物AmBn,则A为金属元素,B为非金属元素,已知A的原子序数为a,则离子中A少了一个电子层,B的电子层不变,
若在短周期,A的原子序数为a,则B的原子序数为(a-m)+8-n=a+8-m-n,
若在四、五周期,A的原子序数为a,则B的原子序数为(a-m)+18-n=a+18-m-n,
若在六、七周期,A的原子序数为a,则B的原子序数为(a-m)+32-n=a+32-m-n,
故选C.
点评 本题考查周期表的结构及应用,把握同周期形成离子化合物中最外层电子数相差8或18等为解答的关键,侧重分析与应用能力的考查,注意周期表结构的应用,题目难度不大.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
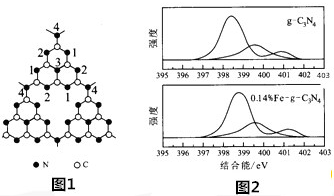 g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.
g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.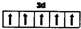 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的密度比乙醇的大 | |
| B. | 乙醇分子中6个氢原子的化学性质完全相同 | |
| C. | 钠与乙醇的反应比钠与水的反应缓和 | |
| D. | 钠与乙醇反应产生的气体可以燃烧,燃烧前必须验纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉遇到KI溶液呈现特殊蓝色 | |
| B. | 淀粉和纤维素属于多糖,其分子式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 多糖一般不溶于水,没有甜味,没有还原性 | |
| D. | 在稀硫酸作用下,淀粉水解生成葡萄糖和果糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
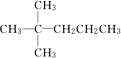 ,该烷烃分子的名称2,2-二甲基戊烷C7H16另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.
,该烷烃分子的名称2,2-二甲基戊烷C7H16另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/mol•L-1 | 6 | 3 | 2 | 2 |
| c(B)/mol•L-1 | 5 | 3.5 | 3 | 3 |
| c(C)/mol•L-1 | 1 | 2.5 | 3 | 3 |
| A. | 在容器中发生的反应为2A+B?2C | |
| B. | 该温度下,此反应的平衡常数为0.25 | |
| C. | A的平衡转化率比B的平衡转化率低 | |
| D. | 起始加入的A、B物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
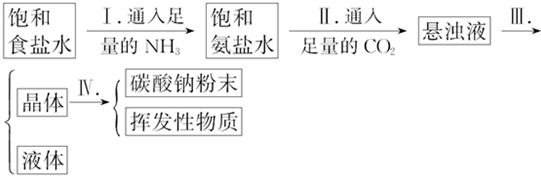
| 温度 盐的溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com