
A、甲中由水电离出来的H+的物质的量浓度是乙中由水电离出来的H+的物质的量浓度的
| ||
| B、物质的量浓度c(甲)=10c(乙) | ||
| C、中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙) | ||
| D、甲中的c(OH-)为乙中c(OH-)的10倍 |
| Kw |
| c(H+) |
| Kw |
| c(H+) |
| Kw |
| c(H+) |


科目:高中化学 来源: 题型:
①甲由水电离出来的H+的物质的量浓度是乙的1/10倍
②物质的量浓度c(甲)=10c(乙) ③中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙)④甲中的c(OH-)为乙中的c(OH-)的10倍
A.①②④正确 B.①③正确 C.②④正确 D.只有①正确
查看答案和解析>>
科目:高中化学 来源:2013届北京市高二上学期期中测试化学试卷 题型:选择题
常温下,甲、乙两杯醋酸稀溶液,甲的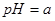 ,乙的
,乙的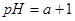 ,对下列叙述的判断正确的是
,对下列叙述的判断正确的是
A. 甲中水电离出来的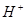 的物质的量浓度是乙中水电离出来的
的物质的量浓度是乙中水电离出来的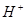 的物质的量浓度的10倍
的物质的量浓度的10倍
B. 物质的量浓度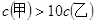
C. 中和等物质的量的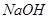 溶液需甲、乙两杯醋酸溶液的体积,V(甲)=10V(乙)
溶液需甲、乙两杯醋酸溶液的体积,V(甲)=10V(乙)
D. 甲中的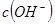 为乙中的
为乙中的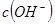 的10倍
的10倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com