
CH4��H2��CO��ȼ���ȷֱ�Ϊ890.31kJ/mol��285.8kJ/mol��110.5 kJ/mol�������Ȼ�ѧ����ʽ��д��ȷ����
A��CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H=-890.31kJ/mol
B��2H2(g)+ O2(g)= 2H2O(l) ��H=-285.8kJ/mol
C��CO (g)+ H2O(g)= CO2(g)+ H2 (g) ��H=+175.3kJ/mol
D��2CO (g)+ O2(g) = 2CO2(g) ��H=-221 kJ/mol
D
��������
���������ȼ������1mol��������ȫȼ�ղ����ȶ���������ʱ���ų���������A��������̬ˮ�����ȶ���״̬������B.1mol H2ȼ�ղ���Һ̬ˮ�ų�����285.8kJ����2mol H2ȼ�ղ���Һ̬ˮ�ų�����571.6kJ.�����Ȼ�ѧ����ʽ2H2(g)+ O2(g)= 2H2O(l) ��H=-571.6kJ/mol������C��H2�������������D.����ȼ���ȼ���Ӧ�����ʵ����Ĺ�ϵ����ȷ��
���㣺����ȼ�������Ȼ�ѧ����ʽ����д��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
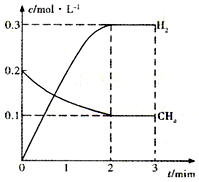 ��ҵ��������Ȼ������Ҫ�ɷ���CH4����H2O���и��������Ʊ��ϳ�����CO+H2����CO��H2��һ�����������Ʊ���ȩ�����ѵȶ����л����֪CH4��H2��CO��ȼ���ȣ���H���ֱ�Ϊ-890.3kJ?mol-1��-285.8kJ?mol-1��-283.0kJ?mol-1��18.0gˮ����Һ��ʱ�������仯Ϊ44.0kJ��
��ҵ��������Ȼ������Ҫ�ɷ���CH4����H2O���и��������Ʊ��ϳ�����CO+H2����CO��H2��һ�����������Ʊ���ȩ�����ѵȶ����л����֪CH4��H2��CO��ȼ���ȣ���H���ֱ�Ϊ-890.3kJ?mol-1��-285.8kJ?mol-1��-283.0kJ?mol-1��18.0gˮ����Һ��ʱ�������仯Ϊ44.0kJ��| t/min | n��CH4��/mol | n��H2O��/mol | n��CO��/mol | n��H2��/mol |
| 4 | 0.18 | 0.38 | 0.22 | 0.66 |
| n(CH4) |
| n(H2O) |
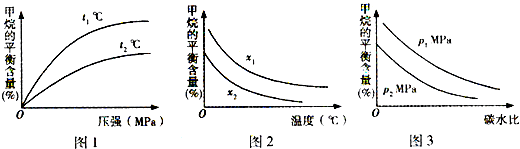
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com