
�ҹ����£�������Ȼ��Ȫˮ���ұ����涨������ˮ�п����°��������ε���ֵ��0.01mg/L����ǰ�ܶ�����ˮ��ҵ�����ó�������������ˮ��������������̿������������Ρ�ԭ����ˮ�е�Br������������ΪBrO2-�������ʾ��Ϊ��Br��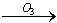 BrO��
BrO��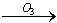 BrO2-
BrO2-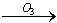 BrO3-�������й�˵����ȷ����
BrO3-�������й�˵����ȷ����
| A��������������������ˮԭ����ͬ���������ý�������ԭ�� |
| B�������������������ɱ������������� |
| C��BrO- 3�����Ա�O3ǿ |
| D�����������εĹ����Ǹ�ˮ�����ĸ���Ӧ���������������BrO3-�IJ��� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��Ӧ��Cr2O72��+3SO32��+aH+=2Cr3++3Y+4H2O����˵������ȷ����
| A��Y��SO42�� |
| B��a=8 |
| C��Cr2O72����������Cr3+ |
| D������1mol Cr3+ʱת�Ƶĵ�������3��6. 02��1023 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����Fe2+��I-��Br-����Һ��ͨ��������������Һ�и������ӵ����ʵ����仯����ͼ��ʾ���й�˵������ȷ����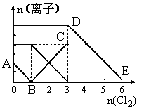
| A���߶�BC����Fe3+���ʵ����ı仯��� |
| B��ԭ�����Һ��c(FeBr2)��6mol/L |
| C����ͨ��Cl22molʱ����Һ���ѷ��������ӷ�Ӧ�ɱ�ʾΪ�� 2Fe2++2I-+2C12��2Fe3++I2+4Cl- |
| D��ԭ��Һ��n(Fe2+):n(I-):n(Br-)��2:1:3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ����
| A���ǽ���Ԫ�أ�ϡ������Ԫ�س��⣩��������Ԫ�أ������ڷ�Ӧ�ж�ֻ���������� |
| B�������£�1 mol����������ϡNaOH��Һ��ȫ��Ӧת��1mol���� |
| C���ڼ��������£����Ҵ���ȥ���������е����� |
| D������ͭ��Һ�����Ե�ԭ��Cu2+ + 2H2O = Cu(OH)2��+ 2H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���������绯������ͭ�����У���һ��Ҫ��Ӧ��CuFeS2��4Fe3��==Cu2����5Fe2����2S����Ӧ������������õ�����x mol������˵����ȷ���� �� ��
| A����Ӧ����Ԫ�ر�������������Ԫ�ؾ�����ԭ |
| B����������Fe3��������������Cu2�� |
| C����Ӧ��ת�Ƶ��ӵ����ʵ���Ϊx mol |
| D����Ӧ���������Һ�����ֽ������ӵ������ʵ���Ϊy mol����ԭFe3���������ʵ���Ϊ(y��x) mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ����
| A����4molHCl��Ũ����������MnO2��ַ�Ӧ��ת��2NA������ |
B��500�桢30MPa�£���0.2mol N2��0.6molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������7.72kJ�����Ȼ�ѧ����ʽΪ��N2(g) + 3H2(g)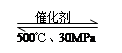 2NH3(g)��H=��38.6kJ��mol��1 2NH3(g)��H=��38.6kJ��mol��1 |
C�����ڿ��淴ӦN2(g)+3H2(g)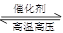 2NH3(g)��H��0�������¶ȣ���ʹ��Ӧ��������Ӧ�����ƶ� 2NH3(g)��H��0�������¶ȣ���ʹ��Ӧ��������Ӧ�����ƶ� |
| D��Ԫ��ԭ�ӵ������������Ķ�������ǽ����Ե�ǿ���ޱ�Ȼ��ϵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��Ϥ�����˻���ʹ�õķ���ǹ���õġ���ҩ���ɷ�������غͺ��ף���ײ������������ͬʱ������ɫ������ײ��ʱ�����Ļ�ѧ����ʽΪ�� 5KClO3 + 6P��3P2O5 + 5KCl ���������й������������ ( )
| A��������Ӧ����������ԭ��Ӧ |
| B��������ɫ������ԭ�������ɵ�P2O5��ɫ����С�������̣���ˮ�Ժ�ǿ�����տ����е�ˮ�֣���������СҺ�Σ����� |
| C������Ͱ���Ϊͬ���칹�壬����������ҩ�еĺ������ð��״��� |
| D��������Ӧ������3molPʱ��ת�Ƶ��ӵ����ʵ���Ϊ15mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ܱ�װ���У��������ƣ�NaClO2��������һ�������·����ֽⷴӦ���������γɵIJ�����
| A��NaCl��O2 | B��NaClO3��NaClO | C��NaClO3��Cl2 | D��NaClO3��NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ijFeBr2��Һ�У�ͨ��1.12L����״������Cl2�������Һ��c(Br-)=3c(Cl-)=0.3mol/L����Ӧ��������Һ������仯���ơ�������˵������ȷ����
| A��ԭ��Һ��Ũ��Ϊ0.1mol/L |
| B����Ӧ����Һ��c(Fe3+)=0.1mol/L |
| C����Ӧ����Һ��c(Fe3+)=c(Fe2+) |
| D��ԭ��Һ��c��Br-��=0.4mol/L |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com