
【题目】下列各组分子中,都属于含极性键的非极性分子的是( )
A. CO2 H2S B. C2H4 CH4 C. C60 C2H4 D. NH3 HCl
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用过量氢氧化钠溶液处理铝土矿并过滤,得到含偏铝酸钠的溶液。向该溶液中通入二氧化碳,已知通入二氧化碳336L(标准状况下),生成24molAl(OH)3和15molNa2CO3,若通入溶液的二氧化碳为112L(标准状况下),生成Al(OH)3的和Na2CO3的物质的量之比为
A. 2:1 B. 1:2 C. 4:5 D. 5:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向某密闭容器中加入X后会发生如下反应:5X(g) ![]() 2Y(g)+Z(g) ΔH<0,测得X的物质的量n(X)随时间t的变化如右图曲线Ⅰ所示,若改变某一条件后,向同种规格的密闭容器中加入等量的X后,测得n(X)随时间t的变化如右图曲线Ⅱ所示,下列说法错误的是
2Y(g)+Z(g) ΔH<0,测得X的物质的量n(X)随时间t的变化如右图曲线Ⅰ所示,若改变某一条件后,向同种规格的密闭容器中加入等量的X后,测得n(X)随时间t的变化如右图曲线Ⅱ所示,下列说法错误的是
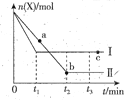
A. 曲线Ⅰ、曲线Ⅱ对应的反应只能是温度不同,且T(Ⅰ)>T(Ⅱ)
B. a、b、c三点对应的气体的平均相对分子质量:a>c>b
C. 平衡时Z的产率:b>c
D. t2-t3时间段内,两种条件下X的平均反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息回答以下与金属元素相关的问题。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为__________。锶比钙的金属性更强,它们的单质都能和水反应放出氢气,则锶与水反应的化学方程式为_____________。颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应那么剧烈,原因是__________。
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为___________, Z的电子式为_____________________。
II. KmnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为_________________。此过程不用瓷坩埚的原因是_________________________。
(4)髙锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为SO42- ),写出检验Mn2+的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常为有机溶剂,其中分子结构为正四面体的是 . 工业上分离这些多氯代物的方法是 .
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式(不考虑立体异构).
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下: ![]()
反应①的化学方程式为 , 反应类型为;反应②的反应类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2NO(g)+O2(g)=2NO2(g)由①、②两步反应构成,其反应进程与能量关系如图,所示。已知:
①NO+O2 =NO3(快反应);②NO3+NO=2NO2(慢反应)。下列说法正确的是
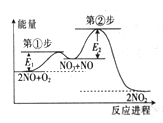
A. NO3比NO稳定
B. ①、②两步反应均为放热反应
C. 第②步的逆反应的活化能更大,因此NO2更容易转化为NO3和NO
D. 升高温度,①、②两步反应速率均加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对石油工业叙述错误的是( )
A.石油含有C5~C11的烷烃,可以通过石油的常压分馏得到汽油
B.催化裂化既能提高汽油产量又能提高汽油质量
C.石油裂解的目的是提高汽油产量
D.石油的减压分馏的生产目的是获得轻质油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=_____,C=_____,E=_____。
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式__________________________________________________。
(3)若t1<t2,则根据实验①和②得到的结论是_____________。
(4)小组同学发现每组实验反应速率随时间的变化总是如图,
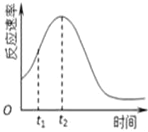
其中t1~t2时间内速率变快的主要原因可能是:
①__________________________________________;
②___________________________________________。
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4·2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL。该KMnO4溶液的物质的量浓度为_____mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com