
【题目】根据信息回答以下与金属元素相关的问题。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为__________。锶比钙的金属性更强,它们的单质都能和水反应放出氢气,则锶与水反应的化学方程式为_____________。颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应那么剧烈,原因是__________。
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为___________, Z的电子式为_____________________。
II. KmnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为_________________。此过程不用瓷坩埚的原因是_________________________。
(4)髙锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为SO42- ),写出检验Mn2+的离子方程式_________________。
【答案】 第四周期,第IIA族 Sr+2H2O = Sr(OH)2↓+H2↑ 产生的微溶物SrSO4覆盖在Sr的表面,阻碍反应进一步进行 0.8mol/L ![]() 2MnO2+4KOH +O2
2MnO2+4KOH +O2 ![]() 2K2MnO4+2H2O 加热时陶瓷要与 KOH 反应 2Mn2++5S2O82-+8H2O=2MnO4-+l0SO42-+16H+
2K2MnO4+2H2O 加热时陶瓷要与 KOH 反应 2Mn2++5S2O82-+8H2O=2MnO4-+l0SO42-+16H+
【解析】I.(1)钙的原子序数为20,在周期表中的位置为第四周期、第IIA族;锶比钙的金属性更强,它们的单质都能和水反应生成相应的碱并放出氢气,则锶与水反应的化学方程式为Sr+2H2O = Sr(OH)2↓+H2↑;因SrSO4微溶于水,会覆盖在Sr的表面,阻碍反应进一步进行故颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应那么剧烈;
(2)锶在一定条件下分别与N2生成氮化锶,化合物中N为-3价,Sr为+2价,化学式为Sr3N2,氮化锶与水反应生成NH3,与稀盐酸反应生成SrCl2和NH4Cl,反应方程式为Sr3N2+8HCl=3SrCl2+2NH4Cl,则0.0lmolSr3N2溶于l00mL盐酸恰好完全反应,消耗HCl为0.08mol,盐酸的物质的量浓度为![]() =0.8mol/L;与H2发生反应生成氢化锶,H为-1价,Sr为+2,则氢化锶的化学式为SrH2,为离子型化合物,其电子式为
=0.8mol/L;与H2发生反应生成氢化锶,H为-1价,Sr为+2,则氢化锶的化学式为SrH2,为离子型化合物,其电子式为![]() ;
;
II.KmnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)MnO2与KOH的混合物在铁坩埚(熔融池)中混合均匀,并加热至熔融,即可得到绿色的K2MnO4,Mn元素化合价从+4价氧化为+6价,空气的氧气作氧化剂,根据电子守恒和原子守恒,此反应的化学方程式为2MnO2+4KOH +O2 ![]() 2K2MnO4+2H2O;因陶瓷中含有SiO2,能与 KOH 反应,故此过程不用瓷坩埚,应选择铁坩埚;
2K2MnO4+2H2O;因陶瓷中含有SiO2,能与 KOH 反应,故此过程不用瓷坩埚,应选择铁坩埚;
(4)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生氧化还原反应,氧化产物为MnO4-,根据电子守恒、电荷守恒及原子守恒,此反应的离子方程式为2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+。


科目:高中化学 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( ) 
A.甲的溶解度大于乙的溶解度
B.两种物质的溶解度都随温度升高而增大
C.t1℃时,甲、乙两种物质的溶液中,溶质质量分数相等
D.t2℃时,甲的饱和溶液溶质质量分数为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)海水淡化后,为检验所得的淡水中是否含有氯离子,通常采用的试剂是
A. AgNO3溶液 B. AgNO3溶液和稀盐酸
C. AgNO3溶液和稀硝酸 D. 以上试剂均可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴液漏斗已知:R﹣OH+HX→R﹣X+H2O
如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.有关数据见表: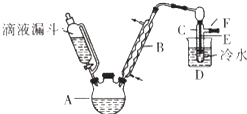
乙醇、溴乙烷、溴有关参数
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/gcm﹣3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是 .
a减少副产物烯和醚的生成 b.减少Br2的生成c减少HBr的挥发 d.水是反应的催化剂
(2)加热的目的是(从速率和限度两方面回答);应采取的加热方式是 .
(3)为除去产品中的一种主要杂质,最好选择下列溶液来洗涤产品.
A.氢氧化钠
B.碘化钠
C.亚硫酸钠
(4)第(3)步的实验所需要的主要玻璃仪器是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分子中,都属于含极性键的非极性分子的是( )
A. CO2 H2S B. C2H4 CH4 C. C60 C2H4 D. NH3 HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的为( )
A. 1s22s22p63s1 B. 1s22s22p63s23p64s1 C. 1s22s22p63s2 D. 1s22s22p63s23p64s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产、可持续发展密切相关,下列说法中正确的是( )
A.“绿色化学”的核心是应用化学原理对环境污染进行治理
B.丙三醇是无色液体,易溶于水和乙醇,可用于配制化妆品
C.苯酚有强腐蚀性,沾在皮肤上可用烧碱溶液洗涤
D.甲烷、乙烯和苯在工业上都可通过石油分馏得到
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com