
【题目】滴液漏斗已知:R﹣OH+HX→R﹣X+H2O
如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.有关数据见表: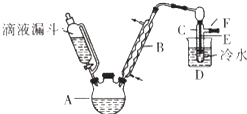
乙醇、溴乙烷、溴有关参数
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/gcm﹣3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是 .
a减少副产物烯和醚的生成 b.减少Br2的生成c减少HBr的挥发 d.水是反应的催化剂
(2)加热的目的是(从速率和限度两方面回答);应采取的加热方式是 .
(3)为除去产品中的一种主要杂质,最好选择下列溶液来洗涤产品.
A.氢氧化钠
B.碘化钠
C.亚硫酸钠
(4)第(3)步的实验所需要的主要玻璃仪器是 .
【答案】
(1)abc
(2)升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动;水浴加热
(3)C
(4)分液漏斗、烧杯
【解析】解:(1)反应中加入少量的水,防止反应进行时发生大量的泡沫,减少副产物乙醚的生成和避免HBr的挥发,故abc正确;
所以答案是:a、b、c;(2)加热的目的是加快反应速率,温度高于38.4°C溴乙烷全部挥发蒸馏出来;为了控制温度,应采取水浴加热,
所以答案是:升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动;水浴加热;(3)A.氢氧化钠,加氢氧化钠会引起溴乙烷水解,故A错误;
B.除去溴乙烷中的少量杂质Br2 , 加碘化亚铁会引入碘单质杂质 故B错误;
C.加亚硫酸钠只与溴反应不与溴乙烷反应,故c正确;
D.碳酸氢钠溶液呈碱性,和溴单质、溴乙烷反应,故D错误;
故选C;(4)洗涤产品分离混合物需要在分液装置中,需要的仪器为分液漏斗,烧杯,遵循“上吐下泻”原则;
所以答案是:分液漏斗、烧杯.


科目:高中化学 来源: 题型:
【题目】经X射线研究证明PCl5在固体时,由空间构型分别是正四面体和正八面体的两种离子构成,下列关于PCl5的推断正确的是( )
A. PCl5 固体是分子晶体
B. PCl5晶体由PCl32+ 和 PCl72— 构成,且离子数目之比为1:1
C. PCl5晶体具有良好的导电性
D. PCl5晶体由PCl4+ 和 PCl6— 构成,且离子数目之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.按系统命名法,化合物 ![]() (键线式结构)的名称是2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
(键线式结构)的名称是2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
B.环己烯与化合物 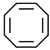 (键线式结构)互为同系物
(键线式结构)互为同系物
C.分子式为C4H8O2的有机物在酸性条件下可水解为酸和醇,若将所有可能得到的醇和酸重新酯化,可形成的酯共有16种
D.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 原电池是把电能转化为化学能的装置 B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 元素周期表中第ⅠA族全部是金属元素 D. 原电池中的阳离子向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息回答以下与金属元素相关的问题。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为__________。锶比钙的金属性更强,它们的单质都能和水反应放出氢气,则锶与水反应的化学方程式为_____________。颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应那么剧烈,原因是__________。
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为___________, Z的电子式为_____________________。
II. KmnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为_________________。此过程不用瓷坩埚的原因是_________________________。
(4)髙锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为SO42- ),写出检验Mn2+的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料。工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如下:
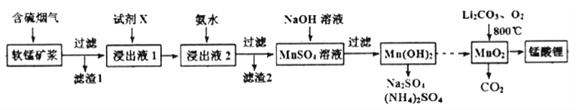
已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质。
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
③部分氢氧化物沉淀相关的溶液pH如下表:
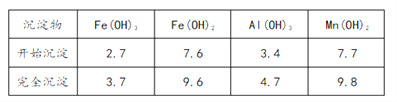
(1)已知:
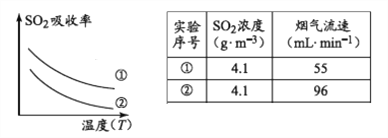
下列措施可提高SO2吸收率的是__________(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是_____________(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是_______________。
(4)锰酸锂可充电电池的总反应式为:Li1-xMnO2+LixC ![]() LiMn2O4+C(x<1)
LiMn2O4+C(x<1)
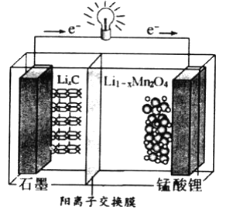
①放电时,电池的正极反应式为__________________
②充电时,若转移1mole-,则石墨电极将增重__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)常用作食品、牙粉、化妆品的添加剂,也可用作种子的消毒剂。已知从溶液中制备的过氧化钙带有8个结晶水,在100℃时会脱水生成米黄色的无水过氧化钙,而无水过氧化钙在350℃时会迅速分解生成CaO和O2。回答下列问题:
①CaO2中含有的化学键类型是________________。
(2)实验室用纯净的CaCO3与H2O2制取过氧化钙的实验步骤如下:

①烧杯A中发生反应的离子方程式为_____________________ 。
②过滤时用到的玻璃仪器除烧杯外,还有______________________。
③用冰水冷却烧杯C的目的是___________________。
(3)为测定产品中CaO2的质量分数,取m g样品,在温度高于350℃时使之充分分解,并将产生的气体(恢复至标准状况)通过下图所示装置,收集到水的体积为V mL,则产品CaO2的质量分数为__________(列出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应A(g)+2B(g)===3C(g)+4D(g)中,表示该反应速率最快的是
A. v(A)=0.2 mol/(L·s) B. v(B)=0.6 mol/(L·s)
C. v(C)=0.8 mol/(L·s) D. v(D)=1 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com