
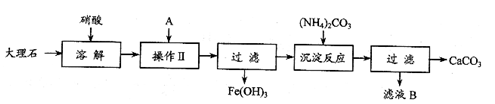

 (1)溶解大理石时,用硝酸而不用硫酸的原因是
(1)溶解大理石时,用硝酸而不用硫酸的原因是  (2)操作Ⅱ中加入的A是少量的氨水,其目的是 。
(2)操作Ⅱ中加入的A是少量的氨水,其目的是 。 (3)写出滤液B的一种用途: 。
(3)写出滤液B的一种用途: 。 (4)写出检验滤液B中是否含Fe3+的方法是
(4)写出检验滤液B中是否含Fe3+的方法是  。
。
 (5)写出加入碳酸铵所发生反应的离子方程式: 。
(5)写出加入碳酸铵所发生反应的离子方程式: 。 或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+)
或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+)

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放射性废水的处理方法主要有稀释排放法、放置衰变法、沥青固化法 |
| B.127I是碘元素稳定的同位素,与131I互为同分异构体 |
| C.127I与131I的质量数不同,核外电子排布方式也不同 |
| D.铯为I A族元素,常温时,0.1mol·L-1的137CsOH溶液,pH<13 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③⑤ | B.②④⑥ | C.③⑦ | D.①③⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
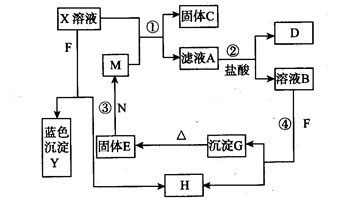
科目:高中化学 来源:不详 题型:填空题
 溶液,生成白色沉淀,过滤后得滤液C;(3)将C分成两份,在一份中加入烧碱溶液,可得蓝色絮状沉淀D;(4)往另一份C中放入一枚新铁钉,有单质E析出。已知A、B、C、D、E相互关系如图所示。
溶液,生成白色沉淀,过滤后得滤液C;(3)将C分成两份,在一份中加入烧碱溶液,可得蓝色絮状沉淀D;(4)往另一份C中放入一枚新铁钉,有单质E析出。已知A、B、C、D、E相互关系如图所示。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
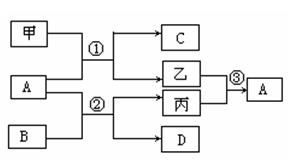
科目:高中化学 来源:不详 题型:单选题
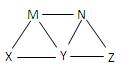
| A.X一定是氢氧化钠溶液 | B.Y一定是硫酸溶液 |
| C.Z可能为碳酸钠溶液 | |
| D.M、N必定各为碳酸氢钠、氢氧化钡溶液中的某一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com