
| A.①②③⑤ | B.②④⑥ | C.③⑦ | D.①③⑥ |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源:不详 题型:填空题
 液反应,其化学式为_▲_。
液反应,其化学式为_▲_。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
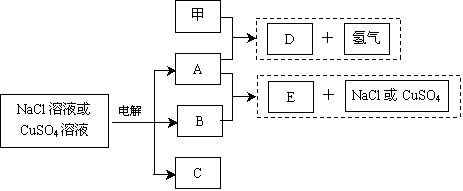

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.IA族元素的金属性一定比IIA族元素的金属性强 |
| B.ⅥA族中氢化物最稳定的元素,其最高价含氧酸的酸性也最强 |
| C.某一元素可能既显金属性,又显非金属性 |
| D.短周期中,同周期元素所形成的简单离子的半径,从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有① | B.只有③ | C.②③④ | D.①②③④都正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
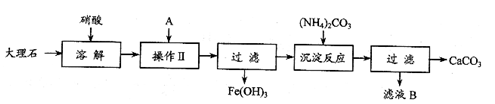

 (1)溶解大理石时,用硝酸而不用硫酸的原因是
(1)溶解大理石时,用硝酸而不用硫酸的原因是  (2)操作Ⅱ中加入的A是少量的氨水,其目的是 。
(2)操作Ⅱ中加入的A是少量的氨水,其目的是 。 (3)写出滤液B的一种用途: 。
(3)写出滤液B的一种用途: 。 (4)写出检验滤液B中是否含Fe3+的方法是
(4)写出检验滤液B中是否含Fe3+的方法是  。
。
 (5)写出加入碳酸铵所发生反应的离子方程式: 。
(5)写出加入碳酸铵所发生反应的离子方程式: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
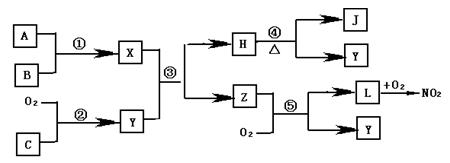
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com