
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的常用试剂是___,证明Fe3+存在的现象是____,配制含Fe2+的溶液时,常常向溶液中加入少量___,使被氧气氧化形成的Fe3+还原为Fe2+。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:___。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:

A.请写出上述实验中加入或生成的有关物质的化学式。
①___,②___,③___,④____,⑤____,⑥_____。
B.请写出相关反应的化学方程式。_______。
【答案】KSCN溶液 溶液变成红色 铁粉 2FeCl3+Cu=2FeCl2+CuCl2 Fe FeCl2 Fe和Cu HCl FeCl2 Cl2 CuCl2+Fe=FeCl2+Cu、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑、2FeCl2+Cl2=2FeCl3
【解析】
(1)检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在;Fe2+容易被空气中的氧气氧化,为了防止亚铁离子被氧化,结合不能引入新杂质分析判断;
(2)铜与氯化铁反应生成氯化铜、氯化亚铁;
(3)反应中含有氯化亚铁、氯化铜和未反应的氯化铁,由工艺流程可知,滤渣③中含有金属铜,应是废液与过量的Fe反应,滤液②中含有氯化亚铁,滤渣③中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液⑤中含有氯化亚铁,与滤液②合并,通入氯气可以得到氯化铁,据此分析解答。
(1)检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液于试管中,滴加KSCN溶液,溶液变红说明存在Fe3+;配制含Fe2+的溶液时,为了防止亚铁离子被氧化,且不能引入新杂质,常加入铁粉(铁钉也可),使被氧气氧化形成的Fe3+还原为Fe2+,故答案为:KSCN溶液;溶液变红;铁粉;
(2)氯化铁与铜反应生成氯化亚铁与氯化铜,反应的化学方程式为:2FeCl3+Cu═2FeCl2+CuCl2,故答案为:2FeCl3+Cu═2FeCl2+CuCl2;
(3)A.废液中含有氯化亚铁、氯化铜和未反应的氯化铁,由工艺流程可知,滤渣③中含有金属铜,应是废液与过量的Fe反应,滤液②中含有氯化亚铁,滤渣③中含有金属铜和未反应的铁,加入盐酸,滤液⑤中也含有氯化亚铁,与滤液②合并后通入氯气可以得到氯化铁,故答案为:Fe;FeCl2;Fe、Cu;HCl;FeCl2;Cl2;
B.废液中加入铁粉,发生CuCl2+Fe=Cu+FeCl2、2FeCl3+Fe=3FeCl2;滤渣中含有铁、铜,加入盐酸,铁与盐酸反应,化学方程式为Fe+2HCl=FeCl2+H2↑,氯化亚铁与氯气的反应,化学方程式为2FeCl2+Cl2=2FeCl3,故答案为:CuCl2+Fe=Cu+FeCl2、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑、2FeCl2+Cl2=2FeCl3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氮元素可形成卤化物,叠氮化物及配合物等许多化合物。下列说法不正确的是( )
A.NF3分子的空间构型为三角锥形
B.叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-,则N2O与N3-互为等电子体
C.叠氮化物与Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,则其中钴的配位数为8
D.NaN3与KN3的结构类似,则NaN3的晶格能大于KN3的晶格能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO![]() 2CO2(g)+N2(g)△H<0
2CO2(g)+N2(g)△H<0
①反应的速率-时间图像如图甲所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图乙所示。以下说法正确的是___________(填对应字母)。
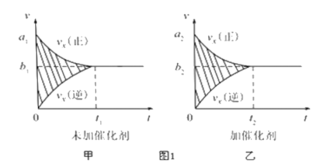
A. a1>a2 B.b1<b2 C.t1>t2 D.图乙中阴影部分面积更大E.图甲中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填代号)

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)![]() N2O4(g)△H=﹣56.9kJ/mol
N2O4(g)△H=﹣56.9kJ/mol
H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:______________。
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如表:
温度/℃ | 800 | 1000 | 1200 | 1400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
①该反应是_________反应(填“吸热”或“放热”)。
②T℃时,向1L密闭容器中投入lmolCH4和lmolH2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O![]() CO+3H2的平衡常数K=______________。
CO+3H2的平衡常数K=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是( )
A.氧化物不可能是分解反应的产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
D.饱和溶液一定比不饱和溶液的浓度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g) ![]() H2(g)+I2(s),若0~15 s内c(HI)由0.1 mol·L-1减小到0.07 mol·L-1,则下列说法正确的是( )
H2(g)+I2(s),若0~15 s内c(HI)由0.1 mol·L-1减小到0.07 mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3mol/L NaOH溶液滴入到25mL 一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。椐图回答:
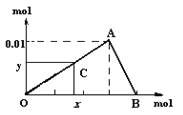
(1)当C点从O点向A点运动时,表示随OH-的不断加入,沉淀量逐渐________。OA曲线表示的离子反应是________________,由此可得A点的坐标为_______;
(2)当C点从A点向B点运动时,表示:_____。AB曲线表示的离子反应为:______,由此可得B点的坐标为:__________。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
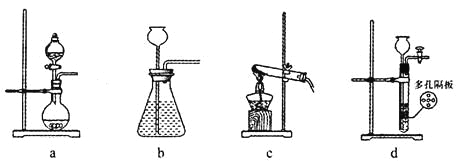
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。
(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为___________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=______________;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将__________(填“增大”、“减小”或“不变”)。
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:
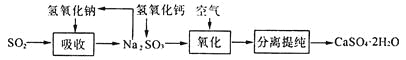
上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知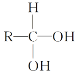
![]() R—CHO。现有A、B、C、D、E、F六种有机物有如下转化关系,其中A的分子式为C4H8O3。下列判断正确的是( )
R—CHO。现有A、B、C、D、E、F六种有机物有如下转化关系,其中A的分子式为C4H8O3。下列判断正确的是( )
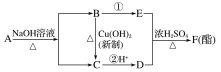
A.有机物A结构可能有四种
B.反应①属于氧化反应
C.有机物B、D的最简式相同
D.有机物E是交警检测酒驾的重要物证
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com