
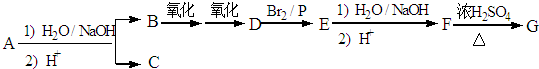
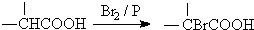
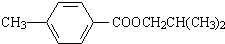 .
. ,该反应属于酯化反应(填反应类型).
,该反应属于酯化反应(填反应类型).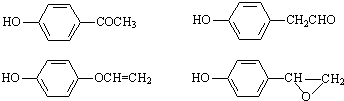 .
.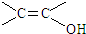 )结构.
)结构.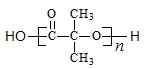 .
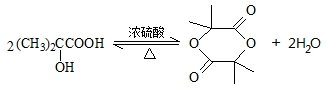
. 分析 化合物A经碱性水解、酸化后得到B和C(C8H8O2),B能二次氧化生成D,说明A是酯,B是醇,则C是羧酸,C(C8H8O2)的核磁共振氢谱表明含有苯环,且苯环上有2种氢原子,则说明苯环上有2个取代基,且两个取代基处于对位,根据C的分子式知,C是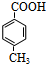 .B经过一系列反应后得到化合物G,G由碳、氢、氧三种元素组成,含氧37.2%,含氢7.0%,则含碳55.8%,分子中碳、氢、氧原子个数比=$\frac{55.8%}{12}$:$\frac{7%}{1}$:$\frac{37.2%}{16}$=2:3:1,G的实验式为C2H3O,令分子式为(C2H3O)x,相对分子质量为172,则(24+3+16)x=172,解得x=4,故G的分子式为C8H12O4,核磁共振氢谱显示只有一个峰,说明G只有一种氢原子;B经过两次氧化生成D,D是羧酸,D和溴、P反应生成E,根据题给信息知,E是含有溴原子的羧酸,E经过水解和酸化后生成F,F是含有羟基的羧酸,由于G分子中只有1种H原子,故应是2分子F自身发生酯化反应生成G为环酯,F应含有2个甲基,故F为
.B经过一系列反应后得到化合物G,G由碳、氢、氧三种元素组成,含氧37.2%,含氢7.0%,则含碳55.8%,分子中碳、氢、氧原子个数比=$\frac{55.8%}{12}$:$\frac{7%}{1}$:$\frac{37.2%}{16}$=2:3:1,G的实验式为C2H3O,令分子式为(C2H3O)x,相对分子质量为172,则(24+3+16)x=172,解得x=4,故G的分子式为C8H12O4,核磁共振氢谱显示只有一个峰,说明G只有一种氢原子;B经过两次氧化生成D,D是羧酸,D和溴、P反应生成E,根据题给信息知,E是含有溴原子的羧酸,E经过水解和酸化后生成F,F是含有羟基的羧酸,由于G分子中只有1种H原子,故应是2分子F自身发生酯化反应生成G为环酯,F应含有2个甲基,故F为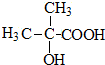 、G为
、G为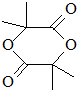 ,逆推可得,E为
,逆推可得,E为 、D为
、D为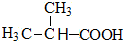 、B为
、B为 ,故A为
,故A为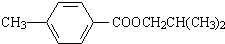 ,据此解答.
,据此解答.
解答 解:化合物A经碱性水解、酸化后得到B和C(C8H8O2),B能二次氧化生成D,说明A是酯,B是醇,则C是羧酸,C(C8H8O2)的核磁共振氢谱表明含有苯环,且苯环上有2种氢原子,则说明苯环上有2个取代基,且两个取代基处于对位,根据C的分子式知,C是 .B经过一系列反应后得到化合物G,G由碳、氢、氧三种元素组成,含氧37.2%,含氢7.0%,则含碳55.8%,分子中碳、氢、氧原子个数比=$\frac{55.8%}{12}$:$\frac{7%}{1}$:$\frac{37.2%}{16}$=2:3:1,G的实验式为C2H3O,令分子式为(C2H3O)x,相对分子质量为172,则(24+3+16)x=172,解得x=4,故G的分子式为C8H12O4,核磁共振氢谱显示只有一个峰,说明G只有一种氢原子;B经过两次氧化生成D,D是羧酸,D和溴、P反应生成E,根据题给信息知,E是含有溴原子的羧酸,E经过水解和酸化后生成F,F是含有羟基的羧酸,由于G分子中只有1种H原子,故应是2分子F自身发生酯化反应生成G为环酯,F应含有2个甲基,故F为
.B经过一系列反应后得到化合物G,G由碳、氢、氧三种元素组成,含氧37.2%,含氢7.0%,则含碳55.8%,分子中碳、氢、氧原子个数比=$\frac{55.8%}{12}$:$\frac{7%}{1}$:$\frac{37.2%}{16}$=2:3:1,G的实验式为C2H3O,令分子式为(C2H3O)x,相对分子质量为172,则(24+3+16)x=172,解得x=4,故G的分子式为C8H12O4,核磁共振氢谱显示只有一个峰,说明G只有一种氢原子;B经过两次氧化生成D,D是羧酸,D和溴、P反应生成E,根据题给信息知,E是含有溴原子的羧酸,E经过水解和酸化后生成F,F是含有羟基的羧酸,由于G分子中只有1种H原子,故应是2分子F自身发生酯化反应生成G为环酯,F应含有2个甲基,故F为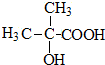 、G为
、G为 ,逆推可得,E为
,逆推可得,E为 、D为
、D为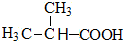 、B为
、B为 ,故A为
,故A为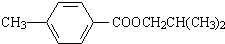 .
.
(1)由上述分析可知,E为 ,分子式为,故答案为:C4H7BrO2;
,分子式为,故答案为:C4H7BrO2;
(2)由上述分析可知,A的结构简式为: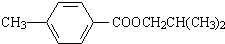 ,故答案为:
,故答案为: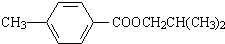 ;
;
(3)F→G反应的化学方程式: ,属于酯化反应,
,属于酯化反应,
故答案为: ,酯化反应;
,酯化反应;
(4)满足下列条件的C( )的同分异构体:①是苯的对位二取代化合物; ②能与FeCl3溶液发生显色反应,含有酚羟基,③不考虑烯醇(
)的同分异构体:①是苯的对位二取代化合物; ②能与FeCl3溶液发生显色反应,含有酚羟基,③不考虑烯醇(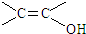 )结构,符合条件的同分异构体有:
)结构,符合条件的同分异构体有: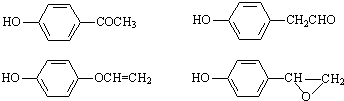 ,
,
故答案为: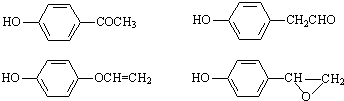 ;
;
(5)在F→G的转化过程中,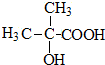 可以发生缩聚反应反应生成高聚物
可以发生缩聚反应反应生成高聚物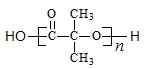 ,
,
故答案为: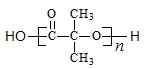 .
.
点评 本题考查有机物推断、有机反应类型、同分异构体的判断以及方程式书写等,题目综合性强,能较全面地考查学生的有机化学基础知识和逻辑思维能力,关键是熟练掌握常见官能团的结构、性质以及官能团之间的相互转化,难度中等.


科目:高中化学 来源: 题型:选择题
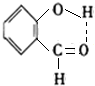
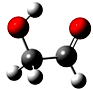 迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )
迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )| A. | 有2种含氧官能团 | B. | 能发生银镜反应 | ||
| C. | 与葡萄糖互为同系物 | D. | 与乙酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
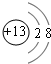 .
.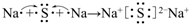 .
.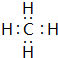 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶液的导电能力很弱 | |
| B. | 溶液中电离出的离子与未电离的分子共存 | |
| C. | 熔化时不导电 | |
| D. | 不是离子化合物而是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: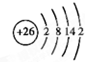 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
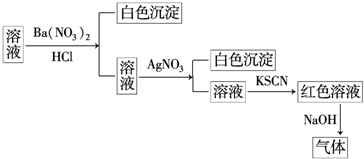
| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
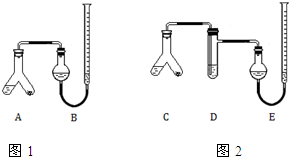 某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

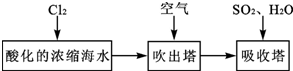
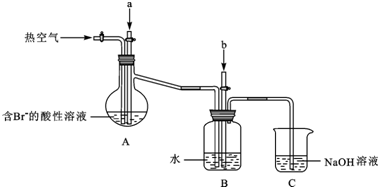
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com