
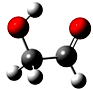
 迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )
迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )| A. | 有2种含氧官能团 | B. | 能发生银镜反应 | ||
| C. | 与葡萄糖互为同系物 | D. | 与乙酸互为同分异构体 |
分析 根据成键结构知,黑色球表示表示C原子、红色球表示O原子、灰色球表示H原子,则乙醇醛的结构简式为HOCH2CHO,含有醇羟基和醛基,具有醇和醛的性质,能发生氧化反应、加成反应、还原反应、取代反应,据此分析解答.
解答 解:根据成键结构知,黑色球表示表示C原子、红色球表示O原子、灰色球表示H原子,则乙醇醛的结构简式为HOCH2CHO,
A.含有醇羟基和醛基两种含氧官能团,故A正确;
B.含有醛基,所以能发生银镜反应,故B正确;
C.该分子中只含一个醇羟基,葡萄糖是含有多个醇羟基,所以二者不是同系物,故C错误;
D.与乙酸分子式相同、结构不同,所以与乙酸互为同分异构体,故D正确;
故选C.
点评 本题考查有机物结构和性质及基本概念,正确判断该物质结构简式是解本题关键,把握官能团及其性质关系,易错选项是C.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题
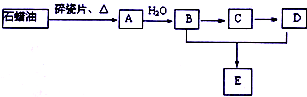 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略).
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略). ;
; ,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.
,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| A. | X、Z、W的简单氢化物的稳定性Z>W>X | |
| B. | W元素的单质在化学反应中只表现还原性 | |
| C. | Y、Z、W的最高价氧化物均能与NaOH溶液反应 | |
| D. | X、Y的简单离子半径Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.
氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
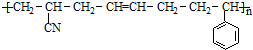 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和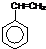 (写结构简式).
(写结构简式).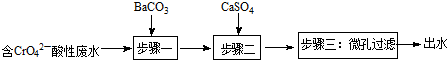
| 物质 | BaCO3 | CaSO4 | BaSO4 |
| Ksp | 8.1×10-9 | 9×10-6 | 1.1×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
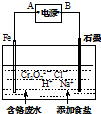
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
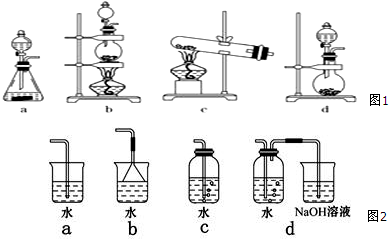
| A. | 乙烯通入溴的四氯化碳溶液发生反应 | |
| B. | 苯与浓硝酸、浓硫酸混和后加热至50℃~60℃发生反应 | |
| C. | 在苯中滴入溴水,振荡后溴水层褪色 | |
| D. | 乙烯通入酸性高锰酸钾溶液后溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
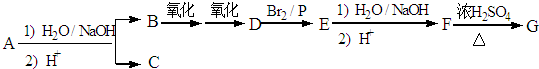
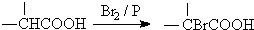
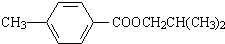 .
.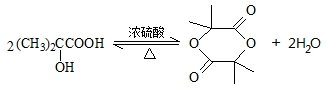 ,该反应属于酯化反应(填反应类型).
,该反应属于酯化反应(填反应类型). .
.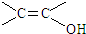 )结构.
)结构.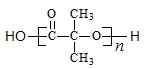 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com