
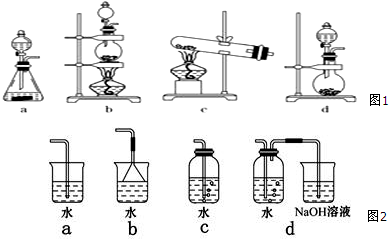
分析 (1)根据从海水制备物质的原理可知,金属单质与非金属单质需要利用化学反应来制取,而食盐可利用蒸发原理,淡水利用蒸馏原理来得到;
(2)电解饱和食盐水生成氯气、氢气和氢氧化钠;
(3)依据反应物状态和反应条件选择合适的装置;
(4)氯气氧化性强于溴,能够置换溴;由于氯气有毒,所以需要对尾气进行吸收;
(5)可以用于冷却镁蒸气应不能与镁反应,据此解答.
解答 解:(1)把海水用蒸馏等方法可以得到淡水,把海水用太阳暴晒,蒸发水分后即得食盐,都不需要化学变化就能够从海水中获得;
故答案为:AC;
(2)电解饱和食盐水生成氯气、氢气和氢氧化钠,化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
(3)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知反应物为固体与液体加热反应,应选择装置:b;
故答案为:b;
(4)氯气与溴化钾反应生成氯化钾和溴单质,方程式:2KBr+Cl2=2KCl+Br2;氯气有毒,应注意尾气吸收,以防污染空气,所以装置d最合理;
故答案为:2KBr+Cl2=2KCl+Br2;d;
(5)能和金属镁发生反应的气体:Cl2、N2、空气,不能与金属镁发生反应的气体:Ar、H2,
故答案为:CE.
点评 本题考查了氯气的制备和海水提溴,明确气体制备原理和性质是解题关键,注意发生装置选择的依据,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:K+、Na+、MnO4-、SO42- | |
| B. | pH=11溶液:CO32-、Na+、K+、SO32- | |
| C. | 由水电离的 c(H+)=10-12 mol•L-1,溶液:Cl-、HCO3-、NO3-、Na+ | |
| D. | 酸性溶液:Fe2、NO3-、Cl-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| B. | 向AgCl的饱和溶液中加入KCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) | |
| C. | 常温下,AgCl在饱和KCl溶液中的Ksp比在纯水中的Ksp小 | |
| D. | 将0.001 mol•L-1的AgNO3溶液滴入NaCl和NaI的混合溶液中,一定先产生AgI沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
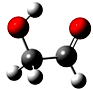 迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )
迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )| A. | 有2种含氧官能团 | B. | 能发生银镜反应 | ||
| C. | 与葡萄糖互为同系物 | D. | 与乙酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应4 min时,若HCl浓度为0.12 mol•L-1,则H2反应速率为0.03 mol•L-1•min-1 | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3 溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| D. | 苯(液溴):加入NaOH溶液,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
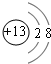 .
.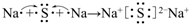 .
.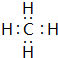 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
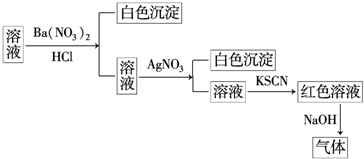
| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com