

分析 A、B在常温下均为气态,A在标准状况下的密度为1.25g/L,则相对分子质量为1.25×22.4=28,则A为乙烯,其结构简式为CH2=CH2,乙烯水化得到E为CH3CH2OH,B可以发生氧化反应、还原反应,其氧化产物G与乙醇反应得到X,应是发生酯化反应,且X有银镜反应,可知B为HCHO,甲醛氧化生成G为HCOOH,X为甲酸乙酯HCOOCH2CH3,甲醛还原生成F为CH3OH,X与Y都是酯,X和Y互为同分异构体,则Y为CH3COOCH3,故C为CH3CHO,D为CH3COOH,据此解答.
解答 解:A、B在常温下均为气态,A在标准状况下的密度为1.25g/L,则相对分子质量为1.25×22.4=28,则A为乙烯,其结构简式为CH2=CH2,乙烯水化得到E为CH3CH2OH,B可以发生氧化反应、还原反应,其氧化产物G与乙醇反应得到X,应是发生酯化反应,且X有银镜反应,可知B为HCHO,甲醛氧化生成G为HCOOH,X为甲酸乙酯HCOOCH2CH3,甲醛还原生成F为CH3OH,X与Y都是酯,X和Y互为同分异构体,则Y为CH3COOCH3,故C为CH3CHO,D为CH3COOH.
(1)由上述分析可知,B的结构简式:HCHO,故答案为:HCHO;
(2)银氨溶液的配制过程:在洁净的试管里加入 2%的AgNO3溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止,
故答案为:在洁净的试管里加入 2%的AgNO3溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止;
(3)C→D是乙醛氧化生成乙酸,反应方程式为:2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH,
E+G→X是甲酸与乙醇在浓硫酸作用下发生酯化反应生成甲酸乙酯,化学方程式为:HCOOH+CH3CH2OH$→_{△}^{浓硫酸}$HCOOCH2CH3+H2O,
故答案为:2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH;HCOOH+CH3CH2OH$→_{△}^{浓硫酸}$HCOOCH2CH3+H2O.
点评 本题考查有机物的推断,计算确定A的结构简式,再根据发生的反应进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.


科目:高中化学 来源: 题型:多选题
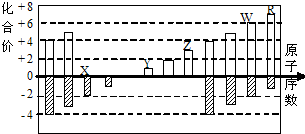 如图是部分短周期元素化合价与原子序数的关系图
如图是部分短周期元素化合价与原子序数的关系图| A. | 离子半径比较:W>R>X>Y>Z | |
| B. | W的气态氢化物的还原性和稳定性均弱于R的氢化物 | |
| C. | 工业上电解熔融的ZR3制备Z单质 | |
| D. | 含Y元素的盐溶液可能显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 实验编号 | 温度 | 金属铝形态 | 酸及其浓度 |
| 1.实验Ⅰ和Ⅱ探究盐酸浓度对该反应速率的影响 2.实验Ⅱ和Ⅲ探究:③ 3.实验Ⅱ和Ⅳ探究金属规格(铝片、铝粉)对该反应速率的影响 4.Ⅰ、Ⅱ、Ⅲ实验探究铝与稀盐酸和稀硫酸反应的差异 | Ⅰ | 25℃ | 铝片 | 4.0moL/L盐酸 |
| Ⅱ | 25℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅲ | 35℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅳ | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| Ⅴ | 25℃ | 铝片 | 2.0mol•L-1硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.
氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 钢铁发生吸氧腐蚀时,电子流动方向可用图甲示意图表示 | |
| B. | 钢铁水闸在发生吸氧腐蚀时,产生铁锈最多的位置在图乙d处 | |
| C. | 用牺牲阳极保护法保护钢铁水闸时,可用图丙所示装置示意 | |
| D. | 用外接电源阴极保护法保护钢铁水闸时,可用图丁所示装置示意 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
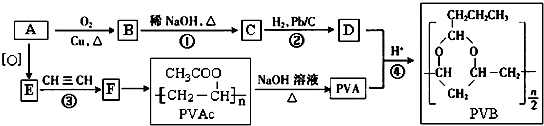
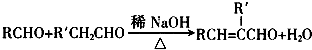 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)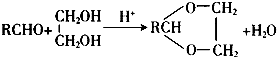
 .
.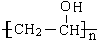 →
→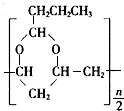 +$\frac{n}{2}$H2O.
+$\frac{n}{2}$H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将纯铁片放入稀硫酸中,反应缓慢,再加入少量硫酸溶液,可加快产生氢气的速率 | |
| B. | 用锌片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 | |
| C. | 反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| D. | 稀盐酸跟锌片反应,加入少量的氯化钠固体,反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极的反应式为CH3OH+H2O-6e-═CO2↑+6H+ | |
| B. | 氧气在电极上的反应是O2+4H++4e-═2H2O | |
| C. | 电池工作时,H+由正极移向负极 | |
| D. | 电池工作时,电子从通入甲醇的一极流出,经外电路流入通入氧气的一极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com