
| A. | 将纯铁片放入稀硫酸中,反应缓慢,再加入少量硫酸溶液,可加快产生氢气的速率 | |
| B. | 用锌片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 | |
| C. | 反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| D. | 稀盐酸跟锌片反应,加入少量的氯化钠固体,反应速率不变 |
分析 A、不知道加入硫酸溶液的浓度,无法判断产生氢气的快慢;
B、浓硫酸与锌反应不生成氢气生成二氧化硫;
C、加入催化剂或升高温度,可增大活化分子百分数;
D、氯化钠不参与反应.
解答 解:A.若加入的硫酸溶液浓度比原硫酸浓度还低,则生成氢气的速率减慢,故A错误;
B.浓硫酸具有强氧化性,常温下与锌反应不生成氢气生成二氧化硫,故B错误;
C.MnO2为反应的催化剂,加入催化剂或升高温度,可增大活化分子百分数,增大反应速率,故C正确;
D.氯化钠不参与反应,加入少量NaCl固体,对溶液中氢离子浓度和锌无影响,则反应速率不变,故D正确;
故选AB.
点评 本题综合考查化学反应速率,侧重于影响化学反应速率的因素的考查,为高考高频考点,难度不大,注意相关基础知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化铝陶瓷、氮化硅陶瓷都属于新型无机非金属材料 | |
| B. | 煤矿井下的瓦斯爆炸主要是氢气燃烧引起的 | |
| C. | 乙烯的产量是衡量一个国家石油化工发展水平的标志 | |
| D. | 在粉尘较多的工作场所,工作人员易患硅肺病 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3 溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| D. | 苯(液溴):加入NaOH溶液,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中的少量溴:加入NaOH溶液,振荡、静置分层后,除去水层 | |
| B. | 除去乙酸乙酯中残留的乙醇:加入乙酸和浓硫酸,然后加热,再分液 | |
| C. | 将红热的铜丝迅速插入乙醇中,反复多次,可观察到铜丝表面变黑,并能闻到香味 | |
| D. | 向淀粉溶液中加入少量稀硫酸并加热,为测定其是否发生水解和是否完全水解,需使用到的试剂有碘水和新制Cu(OH)2悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
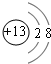 .
.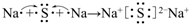 .
.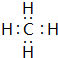 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
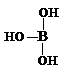 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: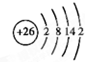 .
.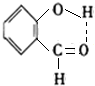 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
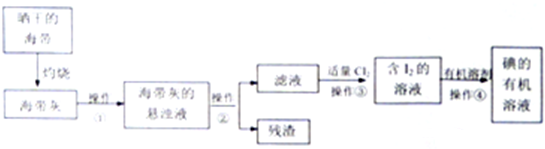
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com