【答案】
分析:(1)根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸的体积;根据配制溶液的体积选取容量瓶.
①根据该操作对配制溶液的浓度是否有影响分析;
②定容的正确操作是继续加蒸馏水至离刻度线下 1-2cm时,改用 胶头滴管加水至液面与刻度线相切.
③根据该操作对配制溶液的浓度是否有影响分析;
(3)根据c=
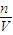
分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答:解:(1)设需要浓硫酸的体积为V,
3.6mol/L×0.1L=18mol/L×V,V=0.02L=20mL;配制溶液的体积是100mL,所以需要100mL的容量瓶.
故答案为:20;100.
(2)①烧杯上沾有溶质,如果不把洗涤液转移到容量瓶中,会导致配制溶液的浓度偏低.
②定容的正确操作是继续加蒸馏水至离刻度线下 1-2cm时,改用 胶头滴管加水至液面与刻度线相切.
③用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,导致溶液的体积偏大,配制溶液的浓度偏低,应重新配制.
故答案为:使溶质完全转移到容量瓶中;1~2cm,胶头滴管; D.
(3)A.溶解搅拌时有液体飞溅,导致溶质的物质的量偏小,所以配制溶液的浓度偏低;
B.定容时俯视容量瓶瓶颈刻度线,导致溶液的体积偏小,配制溶液的浓度偏高;
C.所用容量瓶经蒸馏水洗涤后没有干燥,溶质的物质的量和溶液的体积都未改变,所以无影响;
D.定容时液面超过了刻度线,溶液的体积偏大,所以配制溶液的浓度偏低.
故选B.
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,会根据配制溶液的体积选取容量瓶.

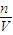 分析操作对溶质的物质的量或对溶液的体积的影响判断.
分析操作对溶质的物质的量或对溶液的体积的影响判断.



