
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)=4NO2(g)+O2(g),△ H>0, T1温度时,向密闭容器中通入N2O5,部分实验数据见表下列说法中不正确的是
时间/s | 0 | 500 | 1000 | 1500 |
c (N2O5) /rnol/L | 5.00 | 3.52 | 2.50 | 2.50 |
A. 500s内用O2表示的平均速率为1.48×10-3mol/(L-s)
B. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
C. T1温度下N2O5的平衡转化率为50%
D. 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时 c(N2O5)>5.00mol/L
【答案】B
【解析】试题分析:A、先由表中信息计算500 s内用N2O5表示的平均速率为![]() molL-1s-1= 2.96×10-3molL-1s-1,再由2 N2O5(g)
molL-1s-1= 2.96×10-3molL-1s-1,再由2 N2O5(g)![]() 4 NO2(g) + O2(g)中O2、N2O5表示的平均反应速率之比等于系数之比可知,则500 s内用O2表示的平均速率为1.48×10-3molL-1s-1,A正确;B、2 N2O5(g)
4 NO2(g) + O2(g)中O2、N2O5表示的平均反应速率之比等于系数之比可知,则500 s内用O2表示的平均速率为1.48×10-3molL-1s-1,A正确;B、2 N2O5(g)![]() 4 NO2(g) + O2(g)的正反应是ΔH > 0的吸热反应,若T1 > T2,若T1 →T2就是降低温度(其它条件不变),平衡向放热方向或逆反应方向移动,则生成物浓度减小、反应物浓度增大,该反应的平衡常数减小,即K1 > K2,B错误;C、先由表中信息可知,N2O5的起始浓度、平衡浓度分别为5.00 molL-1、2.50 molL-1,由此推断其变化浓度为2.50 molL-1,再由
4 NO2(g) + O2(g)的正反应是ΔH > 0的吸热反应,若T1 > T2,若T1 →T2就是降低温度(其它条件不变),平衡向放热方向或逆反应方向移动,则生成物浓度减小、反应物浓度增大,该反应的平衡常数减小,即K1 > K2,B错误;C、先由表中信息可知,N2O5的起始浓度、平衡浓度分别为5.00 molL-1、2.50 molL-1,由此推断其变化浓度为2.50 molL-1,再由![]() 可知,T1温度下N2O5的平衡转化率为
可知,T1温度下N2O5的平衡转化率为![]() ×100% = 50%,C正确;D、平衡后其它条件不变,将容器的体积压缩到原来的一半,N2O5的浓度先立即加倍变为5.00 molL-1,然后由于正反应是气体体积增大的方向,缩小容积增大压强导致平衡向气体体积减小的方向或逆向移动,则反应物N2O5的浓度逐渐增大至新平衡,因此再平衡时c(N2O5) > 5.00 molL-1,D正确;答案选B。
×100% = 50%,C正确;D、平衡后其它条件不变,将容器的体积压缩到原来的一半,N2O5的浓度先立即加倍变为5.00 molL-1,然后由于正反应是气体体积增大的方向,缩小容积增大压强导致平衡向气体体积减小的方向或逆向移动,则反应物N2O5的浓度逐渐增大至新平衡,因此再平衡时c(N2O5) > 5.00 molL-1,D正确;答案选B。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】下表中对于相关物质的分类全部正确的是
选项 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
A. | 液氧 | 漂白粉 | Al2O3 | CO |
B. | 生理盐水 | 氢氧化铁胶体 | Na2O2 | 乙醇 |
C. | 碱石灰 | 盐酸 | K2O | Cl2 |
D. | 胆矾 | 水玻璃 | CaO | SO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 含有共价键的化合物一定是共价化合物
B. 含有离子键的化合物一定是离子化合物
C. 在离子化合物中可能存在共价键
D. 在共价化合物中不可能存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图所示。下列说法正确的是( )

A. 甲是N2O4
B. a点处于平衡状态
C. t1~t2时间内v正(乙)<v逆(甲)
D. 反应进行到t2时刻,改变的条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,在相同的时间里,铁腐蚀程度最大的是( )
A.将生铁放在煮沸过的水里
B.将白铁片(镀锌铁)放在溶有CO2的水中
C.将有磨损的马口铁(镀锡铁)放在溶有CO2的水中
D.将有磨损的放在白铁片(镀锌铁)溶有CO2的水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键 | C—C | C===C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
上表数据可以计算出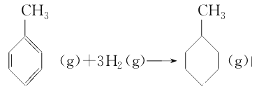 的焓变
的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是
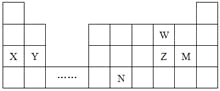
A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA (g) +nB (g) ==C (g) +gD (g);△H <0,下列结论中错误的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m: n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、________、________。
(2)量取反应物时,取50 mL 0.50 mol/L的盐酸,常常还需加入的试剂是________(填序号)。
A.50 mL 0.50 mol/L NaOH溶液 B.50 mL 0.55 mol/LNaOH溶液
C.55 mL 0.50mol/LNaOH溶液 D.1g固体NaOH
(3)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两
组测定中和热的实验,实验试剂及其用量如下表所示。
反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ/mol |
A.1.0 mol/LHCl溶液50 mL、1.1 mol/L NaOH溶液50 mL | 13.0 | ΔH1 | |
B.1.0 mol/L HCl溶液50 mL、1.1 mol/L NH3·H2O溶液50 mL | 13.0 | ΔH2 |
①甲在实验之前预计ΔH1=ΔH2,他的根据可能是__________________________;乙在实验之前预计ΔH1≠ΔH2,他的根据是________________________________________________。
②实验测得的温度是:A的起始温度为13.0 ℃、终了温度为19.8 ℃;B的起始温度13.0 ℃、终了温度为19.3 ℃。设充分反应后溶液的比热容c=4.184 J/(g·℃),忽略实验仪器的比热容及溶液体积的变化,则ΔH1=_____________________ (假设溶液密度均为1 g/cm3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com