
| A、都属于芳香烃 |
| B、都能在空气中燃烧 |
| C、都能使KMnO4酸性溶液褪色 |
| D、都能发生取代反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ |
| B、已知C(石墨,s)═C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C、己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2则△H1>△H2 |
| D、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol苯分子中含有C=C双键数为1.5NA |
| B、2.8g乙烯、丙烯和聚乙烯的混合物中所含碳原子数为0.2NA |
| C、标准状况下,2.24L C5H12含有的共用电子对为1.6NA |
| D、1mol甲基(-CH3)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
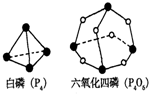 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能:P-P 198KJ?mol-1、P-O 360kJ?mol-1、O=O 498kJ?mol-1.则关于1mol P4和3mol O2完全反应(P4+3O2=P4O6)的热效应说法正确的是( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能:P-P 198KJ?mol-1、P-O 360kJ?mol-1、O=O 498kJ?mol-1.则关于1mol P4和3mol O2完全反应(P4+3O2=P4O6)的热效应说法正确的是( )| A、该反应是吸热反应且吸收热量1638 kJ |
| B、该反应是放热反应且放出热量1638 kJ |
| C、该反应反应物的内能低于产物内能 |
| D、该反应反应物的键能之和高于产物键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
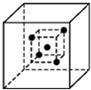 金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体).请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体).请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )| A、12,大立方体的12条棱的中点 |
| B、8,大立方体的8个顶角 |
| C、6,大立方体的6个面的中心 |
| D、14,大立方体的8个顶角和6个面的中心 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海底如“土豆”般的金属结核矿含有铁、锰、钴等多种元素,可用铝热法冶炼并分离得到各种金属单质 |
| B、海水淡化工厂可与化工生产结合,如淡化后的浓海水,可用于提溴、镁、钠等 |
| C、海水中的金、铀等元素储量高、浓度低,提炼时,须先富集 |
| D、海水提镁过程中,所需的石灰乳,可用贝壳煅烧后加水得到,体现了就地取材、降低成本的生产理念 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率:乙>甲 |
| B、平衡后N2的浓度:乙>甲 |
| C、H2的转化率:乙>甲 |
| D、平衡混合气中H2的体积分数:乙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com